
 (2011?佛山)现有一种碱性调味液,是碳酸钠和氯化钠组成的溶液.为了测定碱性调味液中碳酸钠和氯化钠的质量分数,设计了如下实验方案.
(2011?佛山)现有一种碱性调味液,是碳酸钠和氯化钠组成的溶液.为了测定碱性调味液中碳酸钠和氯化钠的质量分数,设计了如下实验方案.| 第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
| 盐酸的质量/g | 20 | 40 | 60 |
| 生成气体的质量/s | 2.2 | 4.4 | 5.5 |
| 碳酸钠的质量 |
| 碱性调味液的质量 |
| 氯化钠的质量 |
| 碱性调味液的质量 |
| 106 |
| x |
| 44 |
| 5.5g |
| 13.25g |
| 100g |
| 73 |
| y |
| 44 |
| 2.2g |
| 3.65g |
| 20g |
| 36.5 |
| 1.825g |
| 143.5 |
| z |
| 58.5 |
| a |
| 143.5 |
| 50.225g |
| 117 |
| b |
| 44 |
| 5.5g |
| 5.85g |
| 100g |


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:初中化学 来源: 题型:
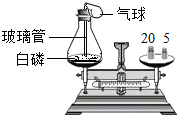 (2011?佛山)为了研究质量守恒定律,设计了右图“白磷燃烧前后质量测定”的实验,请分析有关问题:
(2011?佛山)为了研究质量守恒定律,设计了右图“白磷燃烧前后质量测定”的实验,请分析有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com