
为测定某地石灰石样品中碳酸钙的质量分数,进行以下实验;向装有5.0g石灰石样品的烧杯中,加入23.6g稀盐酸,恰好完全反应,烧杯中剩余物质的总质量随时间变化关系如下表:(石灰石中的杂质不参加反应且难溶于水,生成的气体全部逸出)
|
时间/min |
t1 |
t2 |
t3 |
t4 |
t5 |
t6 |
|
烧杯中剩余物质的总质量/g |
28.35 |
28.1 |
27.85 |
27.6 |
27.5 |
27.5 |
求:
(1)最终生成二氧化碳多少克;
(2)样品中碳酸钙的质量分数;
(3)将反应后烧杯中的剩余物质加入30.5克水变成不饱和溶液后进行过滤,可以得到滤液的溶质质量分数是多少?
(1)1.1g; (2)50%; (3)5%
【解析】
试题分析:(1)由于石灰石样品中的碳酸钙能与稀盐酸反应,生成氯化钙、水和二氧化碳(逸出),故反应后烧杯中剩余物质的总质量会减小,根据质量守恒定律可知,减少的质量即为生成的二氧化碳的质量,结合实验数据可知,烧杯中最终剩余物质的总质量是27.5g,所以生成的二氧化碳质量是5g+23.6g-27.5g=1.1g。
(2)依据二氧化碳的质量,结合反应的化学方程式,可计算出样品中碳酸钙的质量,进而可求出样品中碳酸钙的质量分数。
解,设样品中CaCO3的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 1.1g
100:44=x:1.1g
解得,x=2.5g
则样品中碳酸钙的质量分数=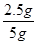 ×100%=50%
×100%=50%
答:样品中碳酸钙的质量分数为50%。
(3)根据题意,由于石灰石样品中的碳酸钙能与稀盐酸反应,生成氯化钙、水和二氧化碳(逸出),而石灰石中的杂质不参加反应且难溶于水,故当加入23.6g稀盐酸,二者恰好完全反应时,所得溶液恰好为反应生成的CaCl2溶液,则同样依据化学方程式,可求出生成的氯化钙质量,再除以最后所得溶液的质量,即可求得滤液的溶质质量分数。
解,设反应生成的CaCl2的质量为y,
CaCO3+2HCl=CaCl2+H2O+CO2↑
111 44
y 1.1g
111:44=y:1.1g
解得,y=2.775g
则得到滤液的溶质质量分数=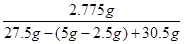 ×100%=5%
×100%=5%
答:得到滤液的溶质质量分数是5%。
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
点评:此题是关于化学方程式的计算题,主要是利用图表及反应方程式来分析和解决化学计算中的有关问题,要求学生有较强的数据分析能力;解题的关键是要能通过数据的比较,结合质量守恒定律,判断出反应生成的二氧化碳的质量,然后根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| 时间/min | t1 | t2 | t3 | t4 | t5 | t6 |
| 烧杯中剩余物质的总质量/g | 28.35 | 28.1 | 27.85 | 27.6 | 27.5 | 27.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 时间/min | t1 | t2 | t3 | t4 | t5 | t6 |
| 烧杯中剩余物质的总质量/g | 56.7 | 56.2 | 55.7 | 55.2 | 55.0 | 55.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 时间/min | t1 | t2 | t3 | t4 | t5 | t6 |
| 烧杯中剩余物质的总质量/g | 56.7 | 56.2 | 55.7 | 55.2 | 55.0 | 55.0 |
查看答案和解析>>
科目:初中化学 来源:2012年广西贵港市中考化学试卷(解析版) 题型:填空题
| 时间/min | t1 | t2 | t3 | t4 | t5 | t6 |
| 烧杯中剩余物质的总质量/g | 56.7 | 56.2 | 55.7 | 55.2 | 55.0 | 55.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com