【答案】
分析:[讨论交流]
(1)要把沉淀池中有固体与液体分离,分离不溶性固体与液体混合物的方法称为过滤,过滤操作需要的玻璃仪器有漏斗、烧杯和玻璃棒;
(2)根据流程图分析煅烧炉中发生反应并用化学方程式表示出来.根据沉淀池内的反应可知,过滤出的滤渣碳酸钙进入煅烧炉,高温下分解;
进一步结合反应的生成物及流程图的提示信息,判断循环利用的物质并写出化学式.沉淀池需要不断通入气体氨气和二氧化碳,所以碳酸钙分解出的二氧化碳气体就可以通入沉淀池进行循环利用;
(3)分析应用溶解度曲线图所做出结论的正误.考查溶解度曲线图的正确使用:曲线上的点为该温度下的饱和溶液,曲线下方的点表示的溶液为不饱和溶液;
[实验探究]
(2)制取气体NH
3的反应物的状态和反应条件选择反应所需要的装置;利用题中信息“化合生成一种盐”分析氨气与稀硫酸反应在,并写出反应的化学方程式;
[交流讨论]
甲:反应过程中产生的气体中会混有水蒸气,使吸收装置质量增加而造成实验数据的误差;
乙:增加干燥装置后,排除了混在气体中水蒸气对结果的影响,但装置内会有氨气残留未能排出,吸收装置不能全部吸收所产生的氨气,造成实验结果的不准确;
[探究结论]
根据实验数据通过化学计算,判断所生成的硫酸铵化肥的等级.
方法一:根据反应(NH
4)
2SO
4+2NaOH
Na
2SO
4+2NH
3↑+2H
2O利用放出氨气的质量求出样品硫酸铵的质量,再根据硫酸铵的质量计算出样品中N元素质量,最后转化为样品中N元素含量并与指标进行核对,得出样品的品质等级;
方法二:根据元素守恒,直接利用实验数据中氨气的质量计算出样品中N元素质量,再转化为含量并与指标核对,得出样品品质.
解答:解:[讨论交流]
(1)分离沉淀池中CaCO
3沉淀和(NH
4)
2SO
4溶液,应采取过滤操作,操作需要的玻璃仪器有漏斗、烧杯和玻璃棒.
故答:过滤,漏斗;
(2)过滤出的滤渣碳酸钙进入煅烧炉高温下分解生成氧化钙和二氧化碳
故选CaCO
3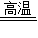
CaO+CO
2↑;
流程图的提示沉淀池需要不断通入气体氨气和二氧化碳,碳酸钙分解出二氧化碳气体,所以通入沉淀池进行循环利用的气体X应是二氧化碳气体;
故选CO
2;
(3)利用溶解度曲线图可查找某温度下的溶解度,可判断溶解度与温度的关系等.
①根据曲线图可查得70℃硫酸铵的溶解度为90g,说法正确;
②图中A点处于曲线下方,曲线下方的点都是不饱和溶液,所以溶液A为不饱和溶液的说法正确;
③B点在曲线上,表示此点溶液为90℃时的饱和溶液,因此要把A点20℃的不饱和溶液变成90℃的饱和溶液,采取蒸发浓缩的方法既减少水的量又可以升高温度,可以实现A点到B点的转化.说法正确;
④C点表示10℃时的硫酸铵饱和溶液,因此通过冷却结晶利用硫酸铵溶解度随温度降低而减小,使90℃的饱和溶液析出硫酸铵晶体而变成10℃时的硫酸铵饱和溶液.说法正确;
故答:①②③④;
[实验探究]
(2)制取气体发生装置的选择,根据反应物硫酸铵为固体、NaOH溶液为液体且反应条件是加热,所以选择此装置;
故答:固体与液体在加热时发生反应;
题中有信息“化合生成一种盐”,根据质量守恒定律,此盐就含硫酸根和铵根,即盐为硫酸铵.
故答:2NH
3+H
2SO
4=(NH
4)
2SO
4;
[交流讨论]
甲:反应过程中产生的气体中会混有水蒸气,吸收装置吸收的物质为水和氨气;
故答:偏高;
乙:装置内会有氨气残留未能排出,造成实验结果的不准确;
故答:装置内残留的氨气影响含氮的测定结果
[探究结论]根据实验数据通过化学计算,判断所生成的硫酸铵化肥的等级.
解法一:设样品中硫酸铵的质量为X (设和答共1分)
(NH
4)
2SO
4+2NaOH?Na
2SO
4+2NH
3↑+2H
2O
132 34
X 3.4g

解之得硫酸铵的质量x=13.2 g
硫酸铵中所含N元素的质量为:
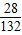
×13.2g=2.8g
样品中N元素的质量分数(含量)为:
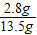
×100=20.7%
∵21.0%>20.7%>20.5%∴所生产的硫酸铵化学只能为合格品
答:该化肥属于合格品.
解法二:根据反应(NH
4)
2SO
4+2NaOH?Na
2SO
4+2NH
3↑+2H
2O可知,生成物氨气中N元素的质量即化肥样品硫酸铵所含N元素质量.
3.4gNH
3中N元素质量为:3.4g×
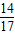
×100%=2.8g
13.5 g硫酸铵化肥样品中N元素的含量为:
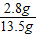
×100%=20.7%
∵21.0%>20.7%>20.5%∴所生产的硫酸铵化学只能为合格品
答:该化肥属于合格品.
点评:题目涉及硫酸铵生产流程分析、硫酸铵溶解度曲线图的意义及应用、硫酸铵化肥品质的鉴定实验及通过化学计算确定化学品质等一系列问题,题目文字量大,涉及的知识点多,充分体现了学生运用知识分析与解决问题的能力.解答时最好能分块处理.


 Na2SO4+2NH3↑+2H2O利用放出氨气的质量求出样品硫酸铵的质量,再根据硫酸铵的质量计算出样品中N元素质量,最后转化为样品中N元素含量并与指标进行核对,得出样品的品质等级;
Na2SO4+2NH3↑+2H2O利用放出氨气的质量求出样品硫酸铵的质量,再根据硫酸铵的质量计算出样品中N元素质量,最后转化为样品中N元素含量并与指标进行核对,得出样品的品质等级; CaO+CO2↑;
CaO+CO2↑; 解之得硫酸铵的质量x=13.2 g
解之得硫酸铵的质量x=13.2 g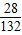 ×13.2g=2.8g
×13.2g=2.8g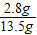 ×100=20.7%
×100=20.7%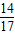 ×100%=2.8g
×100%=2.8g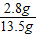 ×100%=20.7%
×100%=20.7%





