
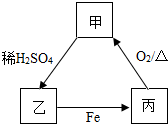
 根据图甲、乙、丙三种物质的转化关系,推测甲为( )
根据图甲、乙、丙三种物质的转化关系,推测甲为( )| A. | 铜 | B. | 碳酸钠 | C. | 氧化铜 | D. | 氢氧化钡 |
科目:初中化学 来源: 题型:解答题
 某化学小组同学利用图示装置进行实验(图中固定装置省略),其中装置甲的试管中盛有固体粉末A,分液漏斗中盛有足量溶液B.
某化学小组同学利用图示装置进行实验(图中固定装置省略),其中装置甲的试管中盛有固体粉末A,分液漏斗中盛有足量溶液B.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaOH 火碱 | B. | Ca(OH)2 消石灰 | C. | NaHCO3 小苏打 | D. | CaCO3石灰石 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
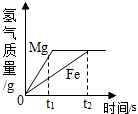 将等质量的镁和铁分别放入等质量、等溶质的质量分数的稀盐酸中,产生氢气的质量与反应时间的关系如图所示,下列说法错误的是( )
将等质量的镁和铁分别放入等质量、等溶质的质量分数的稀盐酸中,产生氢气的质量与反应时间的关系如图所示,下列说法错误的是( )| A. | 反应结束后镁有剩余 | |
| B. | 反应消耗盐酸的总质量相等 | |
| C. | 0~t1时段,与镁反应的HCl的质量大 | |
| D. | 0~t2时段,参加反应的镁的质量与铁相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
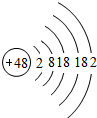 广州市食品监督管理局贡布里餐饮环节一季度食品抽检数据,在抽检的18批次米及米制品中,有8批次产品镉超标.镉是银白色有金属光泽的金属,镉在潮湿空气中缓慢氧化并失去金属光泽,加热时表面形成氧化物层,氧化镉和强氧化镉的溶解度都很小,它们溶于酸,但不溶于碱,认真阅读以上材料回答一下问题:
广州市食品监督管理局贡布里餐饮环节一季度食品抽检数据,在抽检的18批次米及米制品中,有8批次产品镉超标.镉是银白色有金属光泽的金属,镉在潮湿空气中缓慢氧化并失去金属光泽,加热时表面形成氧化物层,氧化镉和强氧化镉的溶解度都很小,它们溶于酸,但不溶于碱,认真阅读以上材料回答一下问题: .该化学式方程式中“
.该化学式方程式中“ ”内对应的化学式为H2O.
”内对应的化学式为H2O.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
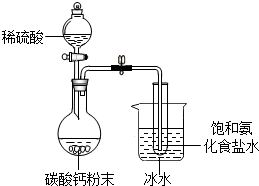 某化学兴趣小组在学习了候氏联合制碱法后,运用下图实验装置和其他实验设备成功制得了纯碱--碳酸钠.
某化学兴趣小组在学习了候氏联合制碱法后,运用下图实验装置和其他实验设备成功制得了纯碱--碳酸钠.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com