

| A. | 丁一定是化合物 | |
| B. | 参加反应的丁的质量一定等于生成甲和丙的质量之和 | |
| C. | 乙可能是这个反应的催化剂 | |
| D. | 该反应可以是碳酸钙或过氧化氢的分解反应 |
分析 本题可分析甲~丁四种物质反应前后各物质的质量分数,确定是反应物还是生成物,据此结合题意进行分析判断即可.
解答 解:由四种物质反应前后各物质的质量分数可知,反应前后甲的质量分数增加了19%-17%=2%,故甲是生成物;乙的质量分数不变,可能作该反应的催化剂,也可能没有参加反应;丁的质量分数减少了(48%-30%)=18%,故丁是反应物;丙的质量分数增加了(41%-25%)=16%,丙是生成物.
A.该反应的反应物为丁,生成物是甲和丙,符合“一分多”的特征,属于分解反应,所以丁一定是化合物,故正确;
B.该反应的反应物为丁,生成物是甲和丙,根据质量守恒定律,参加反应的丁的质量一定等于生成甲、丙的质量之和,故正确;
C.乙的质量分数不变,可能作该反应的催化剂,也可能没有参加反应,故正确;
D.由CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑可知,碳酸钙分解反应各物质的质量比为:25:14:11由2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑可知,过氧化氢的分解反应各物质的质量比是:17:9:8.而该反应的质量是:18%:16%:2%=9:8:1,所以,该反应不可以是碳酸钙和过氧化氢的分解反应,故错误;
故选D.
点评 本题难度不大,考查的是质量守恒定律的应用,解题的关键是分析图中数据,灵活运用质量守恒定律.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
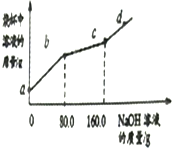 烧杯中盛有CuCl2和HCl的混合溶液100g,向其中滴加10%的NaOH溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示.下列说法正确的是( )
烧杯中盛有CuCl2和HCl的混合溶液100g,向其中滴加10%的NaOH溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示.下列说法正确的是( )| A. | ab段反应产生蓝色沉淀 | B. | bc段烧杯中溶液的质量增加80g | ||
| C. | d点溶液中溶质有2种,且pH>7 | D. | c点对应的溶质质量分数为4.9% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 二甲醚是由碳、氢、氧三种元素组成的有机物 | |
| B. | 二甲醚由2个碳原子、6个氢原子和1个氧原子构成 | |
| C. | 二甲醚中碳元素的质量分数是氢元素的质量分数的4倍 | |
| D. | 二甲醚与甲烷完全燃烧后的产物相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
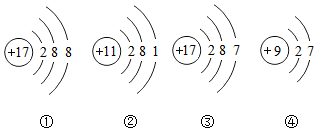
| A. | ③和④是同种元素 | |
| B. | ②在周期表中的位置是第三周期、第IA族 | |
| C. | ①和③化学性质相同 | |
| D. | ③属于阳离子 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com