
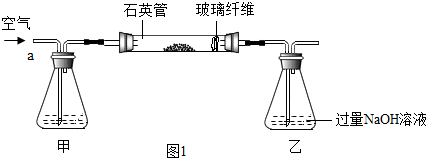


分析 (1)根据空气中的二氧化碳能与氢氧化钠反应影响二氧化硫的测定,据此分析甲装置的作用;
(2)根据过氧化氢具有氧化性,能将亚硫酸钡氧化成硫酸钡进行分析;
(3)根据硫元素质量守恒计算硫化亚铁的质量,再计算出硫化亚铁的质量分数;
(4)根据二氧化碳能与氢氧化钠反应,对计算结果的影响.
(5)根据硫酸钠能与氯化钡反应分析;
(6)根据接触室中发生反应,写出化学方程式,根据溶质质量不变、稀释浓硫酸的正确操作和硫酸的应用分析回答;
(7)根据生产硫酸的工艺流程分析判断.
解答 解:(1)由于空气中的二氧化碳能与氢氧化钠反应影响二氧化硫的测定,所以,Ⅰ中装置中甲瓶内盛放的试剂是氢氧化钠溶液,其作用是吸收空气中的二氧化碳;
(2)由于过氧化氢具有强氧化性,能将亚硫酸钡氧化成硫酸钡,所以,Ⅱ中最终得到的4.66g固体是BaSO4;
(3)由于在化学变化中硫元素质量守恒,所以硫元素的质量:4.66g×$\frac{32}{233}$=0.64g,FeS2的质量:0.64g÷($\frac{64}{120}$×100%)=1.2g,
黄铁矿中FeS2的质量分数为:$\frac{1.2g}{1.6g}$×100%=75%;
(4)如果缺少甲装置,由于二氧化碳能与氢氧化钠反应,则最终测得FeS2的质量分数将会偏大;
(5)由于硫酸钠能与氯化钡反应,所以,Ⅱ中证明所加BaCl2溶液过量的方法是:取滤液少许于试管中,滴加氯化钡溶液,若没有白色沉淀,则氯化钡过量;
(6)由图示可知,在接触室内,二氧化硫和氧气在加热和催化剂的条件下生成了三氧化硫,反应的方程式是:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3;
设需要加水的质量为x,
100g×98%=(100g+x)×10%
x=880g,
稀释时,应将浓硫酸沿烧杯内壁慢慢注入水中,并不断用玻璃棒搅拌由于稀硫酸能与金属氧化物反应,常用于金属除锈;
(7)A.为使黄铁矿充分燃烧,需将其粉碎,能增大与氧气的接触面积,故A正确;
B.催化剂能够提高SO2的反应速率,不能提高产量,故B错误;
C.由生产硫酸的工艺流程可知,SO2可做为生产硫酸的原料循环再利用,故C正确;
D.沸腾炉排出的矿渣中含有氧化铁,可供炼铁,故D正确.
故选:ACD.
故答案为:(1)吸收空气中的二氧化碳;
(2)BaSO4;
(3)75%;
(4)偏大;
(5)取滤液少许于试管中,滴加氯化钡溶液,若没有白色沉淀,则氯化钡过量;
(6)2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,880,浓硫酸,水,除铁锈;
(7)ACD.
点评 本题考查物质成分和含量的测定,涉及仪器选用、误差分析、质量分数计算等知识,具有较强的综合性,解题时注意从质量守恒的角度分析,本题难度中等.


科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 酸能使紫色石蕊试液变红,通入CO2后石蕊试液变红,所以CO2是酸 | |
| B. | 催化剂能改变化学反应的速率,某反应的速率发生改变,一定使用了催化剂 | |
| C. | 一切发声体都在振动,所以,只要振动就能产生声音 | |
| D. | 运动员用力蹬地起跑,原理是物体间力的作用是相互的 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 原子是最小的微粒,不可再分 | |
| B. | 元素是指具有相同质子数的一类原子 | |
| C. | 均一、稳定的液体一定是溶液 | |
| D. | 饱和溶液是指不能再继续溶解任何物质的溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 向锌粒中滴加足量稀硫酸:银白色固体表面出现气泡、固体减少至消失、放热 | |
| B. | 镁在空气中燃烧:发出强光,放出热量,产生大量的白雾 | |
| C. | 向硫酸铜溶液中加入铁钉:紫红色固体表面覆盖一层白色物质,溶液变成浅绿色 | |
| D. | 在空气中点燃一氧化碳:产生明亮的蓝紫色火焰,放出热量 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
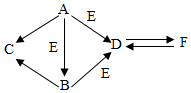 如图为初中化学几种常见物质及其转化关系(部分反应物和生成物以及反应条件被省略).已知A、B、C、D、E、F等是初中化学中常见的物质,其中A为黑色单质,C为红色金属,B、D为氧化物,F是白色不溶于水的物质,请根据图示回答:
如图为初中化学几种常见物质及其转化关系(部分反应物和生成物以及反应条件被省略).已知A、B、C、D、E、F等是初中化学中常见的物质,其中A为黑色单质,C为红色金属,B、D为氧化物,F是白色不溶于水的物质,请根据图示回答:查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com