
(1)�����ֶ������Ͻ����к�̼���ϸߵ��� ��
(2)���dz��á�ͭǽ���ڡ�����������ļ�̣�������һ��������Ҳ�ܷ������ַ�Ӧ������˿�ܹ���������ȼ�գ��÷�Ӧ�Ļ�ѧ����ʽ�� ��
(3)��mg����ͭ��ĩ����μ���ijŨ�ȵ�ϡ���ᣬ�������ϡ����Ϊ100gʱ����ͭǡ����ȫ�ܽ⣬�õ���ɫ��ҺA������ҺA���ټ���һ���������ۣ���ַ�Ӧ�����ˣ��õ�����B����ҺC��������B�м���������ϡ���ᣬ������ð������ַ�Ӧ��ʣ��������ʵ�����Ϊ12.8g��
������B�Ļ�ѧʽ�� ����ҺC�����ʵ������� ��
��m�� ��
����ʽ����ϡ���������ʵ�����������
����ɫ��ҺA�����ʵ��������� ����ȷ��С�����һλ����
��1������ ��2��3Fe+2O2 Fe3O4
Fe3O4
��3����Cu��Fe �������� ��m=16g
��19.6% ��27.6%
��������
�����������1�������ֶ������Ͻ����������ĺ�̼��Ϊ2-4.3%���ֵĺ�̼��Ϊ0.03-2%���ʺ�̼���ϸߵ���������
��2����˿��������ȼ�գ������������������ʸ÷�Ӧ�Ļ�ѧ����ʽ��3Fe+2O2 Fe3O4��
Fe3O4��
��3����������ͭ��ϡ���ᷴӦ����������ͭ��ˮ��������ͭǡ����ȫ��Ӧʱ���õ���ɫ��ҺAΪ����ͭ��Һ����������ͭ��Һ���ټ���һ���������ۣ����߳�ַ�Ӧ����ͭ�������������ʹ��˺õ�����B��һ������ͭ��������������B�м���������ϡ���ᣬ������ð����˵�����л�����ʣ�����������ҺCΪ���ɵ�����������Һ��
������ͭ�������Ӧ�����Գ�ַ�Ӧ��ʣ���12.8g����ȫ����ͭ������Ϊͭ��������������ͭ�е�ͭԪ�أ����У�m��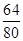 ��100%=12.8g�����m=16g��
��100%=12.8g�����m=16g��
�۸���������д��Ӧ�Ļ�ѧ����ʽ������������ͭ������������ȣ�������μӷ�Ӧ�Ĵ����������������������������������ʽ�����ϡ��������ʵ������������ɡ�
�⣺��ϡ���������ʵ�����Ϊx
CuO + H2SO4 = CuSO4 + H2O
80 98 160
16g x y
80:98=16g��x
��ã�x=19.6g
��ϡ���������ʵ���������=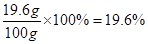
����������Ļ�ѧ��Ӧ����ʽ������������ͭ������ͭ�������ȣ���������ɵ�����ͭ������������������������������ʽ���������ͭ�����ʵ�������������
��80:160=16g��y
��ã�y=32g
��CuSO4��������������=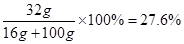
���㣺�����֣������Ļ�ѧ���ʣ������غ㶨�ɣ����ݻ�ѧ��Ӧ����ʽ�ļ���
�����������Ĺؼ��ǣ����������غ㶨�ɣ�����μӷ�Ӧ������ͭ����������������֪����δ֪��Ӧ�������������㼴�ɣ�ע�����Ҫ�淶��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �Ͻ����� |
��̼�� |
| �� |
0.03%��2.0% |
| ���� | 2.0%��4.3% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���Ƹ��ص���ҵ��������ѧ���£� ���ͣ�022
(1)�����ֶ������ĺϽ����ǵ����ܲ�ͬ����;Ҳ��ͬ��������֪����Ʒ�У�________���������Ƴɵģ�________���ɸ��Ƴɵ�(����һ��)��
(2)СúҤ����ͨ�粻�ã��̻���Ʋ��ϣ���ʹ����Ϳ����Ļ�������ը��д�����鱬ը��Ӧ�Ļ�ѧ����ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������������2012����꼶��һ�ν�ѧ������⻯ѧ���� ���ͣ�022
(1)�����ֶ������ĺϽ������ĺ�̼���ȸ�________(��ߡ��͡�)��
(2)�����¹��㡱˵������________��
(3)���Ǵ����·�ͨ������ά֯�ɣ�����(��ȷ��)�����ڵ����ںϳ���ά��������ë����________��ά��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com