
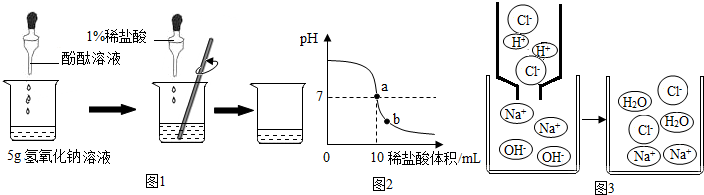
| 实验序号 | A | B | C | D |
| 试剂 | 蒸馏水 | 稀盐酸 | NaOH溶液 | NaCl溶液 |
| 电流强度/mA | 约为0 | 0.09 | 0.09 | 0.09 |
分析 (1)根据中和反应的实质和规律书写化学方程式;
(2)根据镁的化学性质进行分析;
(3)①NaOH溶液中除水分子外还含有自由移动的钠离子和氢氧根离子;
②电流强度与离子浓度成正比来分析;
③氢氧化钠与盐酸反应生成水,使溶液中离子减少来分析;
解答 解:(1)氢氧化钠与盐酸反应生成氯化钠和水;
(2)甲中加1mL水,盐酸没消耗,故加入镁条有气泡产生;乙中加入1mL NaOH溶液后与盐酸反应,故加入镁条无气泡产生或产生气泡较少;
(3)①NaOH溶液中除水分子外还含有自由移动的钠离子和氢氧根离子;
②电流强度与离子浓度有关,实验B、D中电流强度相等,说明等体积的稀盐酸和NaCl溶液中所含Cl-的数目相等;
③氢氧化钠氢氧根离子与盐酸中的氢离子反应生成水,使溶液中离子减少;而 NaOH溶液与氯化钠溶液不反应离子不减少,故I1大于I2.
答案:(1)NaOH+HCl═NaCl+H2O;
(2)甲中有气泡冒出.乙中无气泡(或气泡少);
(3)①Na+和OH-;②相等;③>.
点评 结合课本知识和实验技能,考查了学生的分析问题、解决问题的能力;此题综合性较强,考查出学生将理论知识与实验相结合的能力,还考查学生的创新能力,是一道不错的综合题.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Y>X>Z | B. | X>Z>Y | C. | X>Y>Z | D. | Z>X>Y |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 油锅着火用水浇灭 | B. | 电器着火用泡沫灭火器灭火 | ||
| C. | 用明火检查液化气罐是否漏气 | D. | 火场逃生时用湿毛巾捂住口鼻 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com