15.金属镁是一种重要的金属.小明在做镁带燃烧实验时,发现从实验室中取出来的镁条表面呈灰黑色,这灰黑色物质是什么呢?是氧化镁吗?小明想了一下,很快就把它否定了,他的理由是MgO为白色.小明通过查阅资料灰黑色固体为碱式碳酸镁.
【查阅资料】1.碱式碳酸镁有多种组成.如Mg
2(OH)
2CO
3、Mg
4(OH)
2(CO
3)
3、等,可以表示为xMgCO
3•yMg(OH)
2(x、y都是正整数).
2.MgCO
3 $\frac{\underline{\;\;△\;\;}}{\;}$MgO+CO
2 ↑;Mg(OH)
2 $\frac{\underline{\;\;△\;\;}}{\;}$MgO+H
2O
3.碱式碳酸镁能与盐酸反应生成氯化镁、二氧化碳和水.
Ⅰ.确定镁带表面碱式碳酸镁的成分
小明同学为确定镁带表面碱式碳酸镁的组成,设计如图1所示的实验:
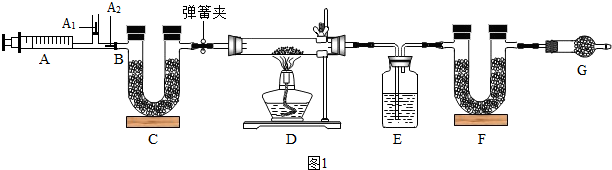
图中B处为两个单向阀:推注射器时A
1关闭,A
2处打开;拉注射器时,A
1打开进空气,A
2关闭.
【实验步骤】
①按图组装好仪器后,检查气密性;
②称取灰黑色样品,并将其放入硬质玻璃管中;
③打开弹簧夹,反复推拉注射器;
④称量E、F的质量,E的质量为87.6g,U型管F的质量为74.7g;
⑤关闭弹簧夹,加热D处试管直到反应不再进行;
⑥打开弹簧夹,再次反复缓缓推拉注射器;
⑦再次称量E、F的质量,E的质量为89.4g,U型管F的质量为87.9g.
【问题讨论】
(1)补充好实验步骤检查气密性,E中所装药品是浓硫酸;
(2)C、F、G中装有碱石灰(CaO与NaOH的固体混合物),则C的作用是防止空气中二氧化碳和水进入F,若没有G装置,则测定的x的值会偏大(填“偏大”、“偏小”、“无影响”);
(3)步骤⑥目的是使产生的气体全部进入EF;
(4)根据上述实验数据,推算该碱式碳酸镁的化学式为3MgCO
3.Mg(OH)
2.
Ⅱ.测定镁带样品纯度如图2所示
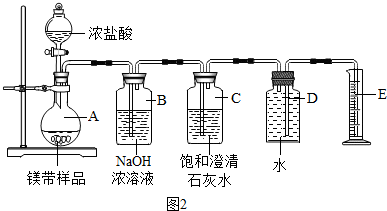
【问题讨论】
(5)装置B的作用是除CO
2和HCl,装置C的作用是检验二氧化碳是否除尽;
(6)称取1.0g镁带样品与足量浓盐酸充分反应后,收集到的氢气的体积为0.448L(已知该实验条件下氢气的密度为0.089g/L),计算镁带样品纯度(写出计算过程).
(7)有同学认为用这种方法测定的结果一定偏大,原因是滴加的盐酸占一定体积.
(8)小江同学认为测定产物中CO
2的质量(即反应前后装置②的质量差)也可测定样品中单质镁的纯度.但利用上述实验装置测得CO
2的质量并计算样品的纯度,结果偏低,你认为原因可能是①②③.(填序号)
①浓盐酸易挥发,产生的氯化氢气体被装置B吸收
②二氧化碳气体逸出时带出的水蒸气在装置B中冷凝而被吸收
③装置A、B内空气中的二氧化碳被装置B吸收
④实验结束时烧瓶中残留二氧化碳
⑤气体从氢氧化钠溶液中逸出时带走部分水蒸气.

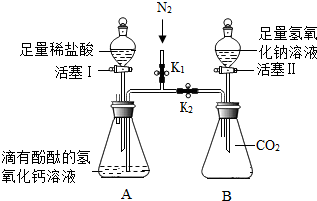 为了证明氢氧化钙溶液与稀盐酸能发生反应,氢氧化钠溶液与二氧化碳能发生反应.如图所示进行实验(装置气密性良好,实验前弹簧夹K1、K2处于关闭状态)
为了证明氢氧化钙溶液与稀盐酸能发生反应,氢氧化钠溶液与二氧化碳能发生反应.如图所示进行实验(装置气密性良好,实验前弹簧夹K1、K2处于关闭状态)