
| 实验序号 | 实验1 | 实验2 | 实验3 | 实验4 |
| 水的质量(g) | 100 | 100 | 100 | 100 |
| 加入硝酸钾的质量(g) | 80 | 100 | 120 | 140 |
| 溶液的质量(g) | 180 | 200 | 210 | 210 |
分析 (1)根据溶液的特点进行判断;
(2)当向水中加入固体后,所得溶液的质量小于二者的质量之和,表明溶液中有溶质固体剩余,所得溶液是该温度下该溶质的饱和溶液,故实验3、4得到的溶液属于饱和溶液,也表明在在该温度下,在100g水中最多能够溶解110g硝酸钾,则实验1、2得到的溶液属于不饱和溶液;溶解度是指在一定温度下,某固体物质在100克溶剂里达到饱和状态时所溶解的质量.对比实验1、2、3、4中的实验数据可知,在该温度下,在100g水中最多能够溶解110g硝酸钾,故该温度下硝酸钾的溶解度是110g;(3)①根据溶质质量=溶液质量×溶质质量分数,溶剂质量=溶液质量-溶质质量进行分析;
②发现托盘天平的指针偏向左盘,说明药品重了,应该减少药品;
③根据需要量取水的体积考虑;
⑤根据使溶质质量分数增大一倍可以用增加溶质或蒸发溶剂的方法实现;
(4)根据锌和硫酸反应生成硫酸锌和氢气,结合题中的数据进行计算.
解答 解:(1)溶液是均一、稳定的混合物,食盐易溶于水形成均一、稳定的混合物,属于溶液,面粉、汽油、碘都不溶于水,不能形成溶液;
(2)实验3中,100g+120g>210g;实验4中,100g+140g>210g;表明实验3、4得到的溶液属于饱和溶液;
在该温度下,在100g水中溶解110g硝酸钾达到饱和,则该温度下硝酸钾的溶解度是110g.
(3)①需要食盐的质量为:50g×6%=3g,水的质量是:50g-3g=47g;
②发现托盘天平的指针偏向左盘,说明药品重了,应该减少药品;
③需要水:50g-50g×6%=47g,即47mL,所以用50mL量筒量取;
⑤设需要加入溶质质量为x,则:
$\frac{3g+x}{50g+x}$×100%=12%
解得X=3.4g,
如果用蒸发溶剂的方法,设蒸发水的质量为y,则:
$\frac{3g}{50g-y}$×100%=12%
解得y=25g,故选C;
(4)设参加反应的稀硫酸为x,
Zn+H2SO4=ZnSO4+H2↑
65 98
32.5g x
$\frac{65}{32.5g}$=$\frac{98}{x}$
x=49g,
所以稀硫酸的溶质质量分数为:$\frac{49g}{245g}$×100%=20%.
故答案为:(1)食盐;
(2)3、4,110;
(3)①3,47;
②D;
③50mL;
⑤C;
(4)20%.
点评 本题考查溶液饱和与不饱和的判断.理解“饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液;溶液饱和的标志是溶液中有固体剩余,且剩余固体的量不再减少”是解此类题的关键.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
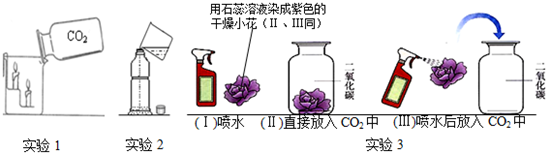
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 实验现象 | 推断(或结论) |
| (1) | 将两种溶液取出并混合 | 混合溶液无色、澄清 | 混合液中肯定不含Cu(NO3)2 |
| 混合时无明显现象 | 混合溶液肯定不是下列组合H2SO4与Na2CO3或HNO3与Na2CO3 | ||
| (2) | 用pH试纸测定混合溶液的pH | 测定的结果:pH=2 | |
| (3) | 向混合溶液中滴入足量Ba(NO3)2 | 有白色沉淀出现 | |
| (4) | 向上述过滤所得的滤液中滴加AgNO3溶液 | 无明显现象 | |
| 混合溶液的可能组合(写出溶质的化学式,有几组写几组、可填满也可不填满) | ①H2SO4、NaNO3②H2SO4、Na2SO4③H2SO4、HNO3④HNO3、Na2SO4 | ||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
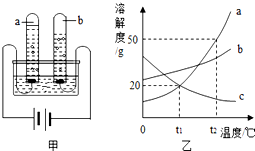 2014年3月22日是第二十二届“世界水日”,水与人类的生活和生产密切相关,请回答下列问题:
2014年3月22日是第二十二届“世界水日”,水与人类的生活和生产密切相关,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com