
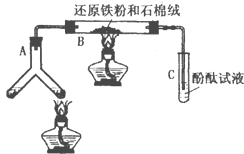
 某版本的化学教材中安排了如图所示“合成氨”的演示实验(夹持仪器均已省略).在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和饱和NH4Cl溶液反应制取N2,N2和H2混合通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,即说明产生了氨气.某课外活动小组通过查阅资料和多次实验,得到了如下信息:
某版本的化学教材中安排了如图所示“合成氨”的演示实验(夹持仪器均已省略).在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和饱和NH4Cl溶液反应制取N2,N2和H2混合通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,即说明产生了氨气.某课外活动小组通过查阅资料和多次实验,得到了如下信息:| N2和H2的体积比 | 5:1 | 3:1 | 1:1 | 1:3 | 1:5 |
| 酚酞变红所需时间/min | 8~9 | 7~8 | 6~7 | 3~4 | 9~10 |


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 错误说法的序号 | 驳斥错误观点的事例或方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
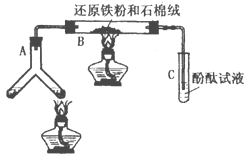 某版本的化学教材中安排了如图所示“合成氨”的演示实验(夹持仪器均已省略).在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和饱和NH4Cl溶液反应制取N2,N2和H2混合通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,即说明产生了氨气.某课外活动小组通过查阅资料和多次实验,得到了如下信息:
某版本的化学教材中安排了如图所示“合成氨”的演示实验(夹持仪器均已省略).在Y形管的一侧用Zn粒和稀H2SO4反应制取H2,另一侧用NaNO2固体和饱和NH4Cl溶液反应制取N2,N2和H2混合通过还原铁粉来合成NH3,再将产生的气体通入酚酞试液中,若酚酞试液变红,即说明产生了氨气.某课外活动小组通过查阅资料和多次实验,得到了如下信息:| N2和H2的体积比 | 5:1 | 3:1 | 1:1 | 1:3 | 1:5 |
| 酚酞变红所需时间/min | 8~9 | 7~8 | 6~7 | 3~4 | 9~10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com