
【题目】过氧化镁(MgO2)是一种镁精细化工产品。在医疗上可用来治疗消化不良、胃酸过多等疾病。在环境保护方面,过氧化镁可用来处理地下水污染的土壤。还可以用于牙膏,对牙齿有漂白和防过敏的作用。某化学兴趣小组对过氧化镁的性质和制备等进行了以下研究。
一.过氧化镁的性质
(1)过氧化镁(其中氧元素的化合价为____)是一种白色的粉末,其外观与物理性质与氧化镁相似。化学性质不够稳定,不溶于水,但逐渐的被分解放出氧气。
过氧化镁有强氧化性,常温下比较稳定,但是加热时会分解生成氧气和氧化镁。请下出该反应的化学方程式________。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2同时温度升高,说明该反应热量__________(填“放出”或“吸收”)。
二.过氧化镁的制备
下图是利用碱式碳酸镁(Mg2(OH)2CO3)和30%的过氧化氢溶液来制取过氧化镁。
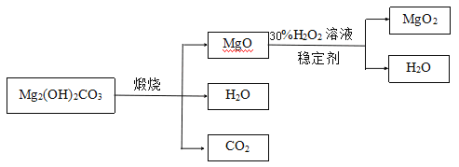
(资料)①碱式碳酸镁与碳酸镁有相似的化学性质,能与稀盐酸反应产生二氧化碳②氧化镁与过氧化氢反应放出大量的热
(3)检测煅烧过程碱式碳酸镁完全分解的方法是_________(写出具体的操作和现象);上述生产过程加入稳定的剂的作用是________。
(4)用上述碱式碳酸镁在550、600、650及700℃下煅烧一定的时间生成氧化镁。用上述条件制备的氧化镁分别与30%双氧水反应合成过氧化镁产率(见图1和图2)。
碱式碳酸镁煅烧的温度适宜控制在________℃,煅烧的时间适宜控制在______h。
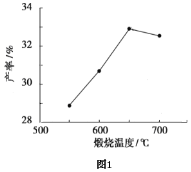
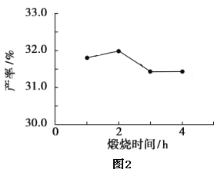
(5)结果在适宜的温度和时间下,碱式碳酸镁能完全分解,并且得到的氧化镁颗粒表面积最大,能与30%过氧化氢充分反应,所以产率高。推测700℃时,产率明显降低的可能的原因____。
三.过氧化镁产品纯度检测
在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑),以下是该小组进行纯度检测的实验装置和实验步骤。

①检查装置气密性,装入药品(样品质量为0.7g),调节刻度管使左右两边液面相平,刻度管度数为10.0mL。
②打开分液漏斗开关,待瓶中无气泡产生时,关闭开关。
③再次调节刻度管使左右两边液面相平,刻度管度数为122mL。
(6)稀盐酸中放入的少量硫酸铜溶液目的是__________。
(7)根据上面实验数据计算样品中过氧化镁的质量分数__________(写出具体的计算过程,实验条件下O2密度为1.429g/L)。
(8)该小组同学所测得质量分数比实际结果偏大,你觉得可能的原因是(_______)
A 生成的氧气有少量溶于水 B 未等装置冷却到室温就开始读数
C 杂质与盐酸反应能产生少量的气体 D 滴入的稀盐酸占了一部分气体的体积
【答案】-1价 2MgO2![]() 2MgO+O2↑ 放热 取少量煅烧后的固体,滴入稀盐酸,无气泡产生 防止过氧化氢受热分解或防止过氧化镁受热分解 650 2 700℃时,生成的氧化镁颗粒的表面积减小,与过氧化氢反应不充分 作过氧化氢分解的催化剂 80% BD
2MgO+O2↑ 放热 取少量煅烧后的固体,滴入稀盐酸,无气泡产生 防止过氧化氢受热分解或防止过氧化镁受热分解 650 2 700℃时,生成的氧化镁颗粒的表面积减小,与过氧化氢反应不充分 作过氧化氢分解的催化剂 80% BD
【解析】
(1)过氧化镁中镁显+2价,设有元素的化合价为x,则+2+2x=0,的x=-1,故过氧化镁中氧元素的化合价为-1;过氧化镁有强氧化性,常温下比较稳定,但是加热时会分解生成氧气和氧化镁,该反应的化学方程式为:![]() ;
;
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2同时温度升高,说明该反应放出热量;
(3)检测煅烧过程碱式碳酸镁完全分解的方法是:取少量煅烧后的固体,滴入稀盐酸,无气泡产生;上述生产过程加入稳定的剂的作用是:防止过氧化氢受热分解或防止过氧化镁受热分解。
(4)根据图1和图2,碱式碳酸镁煅烧的温度适宜控制在650℃,煅烧的时间适宜控制在2h。
(5)在适宜的温度和时间下,碱式碳酸镁能完全分解,并且得到的氧化镁颗粒表面积最大,能与30%过氧化氢充分反应,所以产率高。推测700℃时,产率明显降低的可能的原因是:700℃时,生成的氧化镁颗粒的表面积减小,与过氧化氢反应不充分。
(6)稀盐酸中放入的少量硫酸铜溶液目的是:作过氧化氢分解的催化剂;
(7)设过氧化镁的质量为x,反应后刻度管数为122mL,故生成氧气的体积为122mL-10mL=112mL,由MgO2+2HCl=MgCl2+H2O2,2H2O2![]() 2H2O+O2↑得:
2H2O+O2↑得:

![]()
X=0.56g
所以样品中过氧化镁 的质量分数为![]() ;
;
(8)该小组同学所测得质量分数比实际结果偏大,你觉得可能的原因是:
A、生成的氧气有少量溶于水,会使氧气体积偏小 ,导致测量结果偏小;
B、未等装置冷却到室温就开始读数,气体受热膨胀,会使氧气体积偏大,过氧化镁质量增大 ,故样品中过氧化镁质量分数偏大 ;
C、杂质与盐酸能反应,会使测量结果偏小;
D、滴入的稀盐酸占了一部分气体的体积,会使氧气体积偏大 ,导致测量结果偏大。故选BD。


科目:初中化学 来源: 题型:
【题目】钛和钛合金被认为是21世纪重要的金属材料。钛合金与人体具有很好的“相容性”,可用于制造人造骨骼。工业上以钛铁矿(主要成分为钛酸亚铁,FeTiO3)为原料生产钛,其工业流程示意图如下:
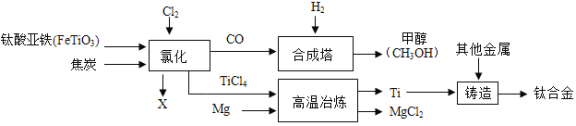
请回答:(1)钛合金属于_______(选填“混合物”、“纯净物”)。
(2)钛酸亚铁FeTiO4中钛的化合价为______价。
(3)以CO和H2在合成塔中生产甲醇(CH3OH)属于化合反应,其化学方程式为________________。
(4)经高温冶炼得到金属钛,则参加反应的镁与生成钛的质量比为_________。
(5)氯化过程中主要发生的反应为2FeTiO3+6C+7Cl2![]() 2TiCl4+2X+6CO,则X的化学式为______。
2TiCl4+2X+6CO,则X的化学式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学设计的工业制备氢氧化钠的流程如图。
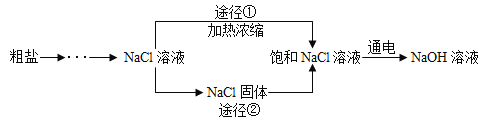
资料:①2NaCl + 2H2O![]() 2NaOH + H2↑+ Cl2↑,电极一端得到 NaOH 和 H2, 另一端得到Cl2。
2NaOH + H2↑+ Cl2↑,电极一端得到 NaOH 和 H2, 另一端得到Cl2。
②Cl2 用于生产 84 消毒液,其反应原理为:Cl2 + 2NaOH = NaCl + NaClO + H2O
(1)晾晒海水得到粗盐的原理是_________。
(2)实验室蒸发用到的仪器材料有铁架台、坩埚钳、石棉网、玻璃棒、酒精灯和______________。
(3)工业生产中应选择途径___________________获得饱和 NaCl 溶液。
(4)84 消毒液有效成分 NaClO 中氯元素的化合价为______________。
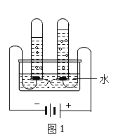
(5)图 1 实验探究水的组成,不能加入NaCl 增强水的导电性的理由是_____________;电解水的化学方程式___________________________________。
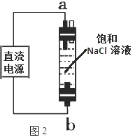
(6)图 2 实验获得 84 消毒液,直流电源正极应与______________ (填 a 或 b)连接, 才能使 NaClO 的含量更高。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】鸡蛋壳的主要成分是碳酸钙,某兴趣小组为了测定某鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯里,然后向其加入80g某浓度的稀盐酸,使之充分反应后,(鸡蛋壳中除CaCO3外的其他成分都不溶于水,不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发)其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半,试计算:
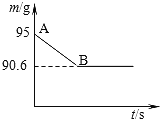
(1)产生CO2的质量为_______g:
(2)计算该鸡蛋壳中CaCO3的质量分数;____________
(3)所用稀盐酸中溶质的质量分数。______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家用石墨烯膜制成“筛子”,可以筛掉盐类物质。当海水流过该膜时,钠离子和氯离子被水分子包裹而不能通过,独立的水分子却能通过(如图)。下列关于石墨烯膜“筛掉”氯化钠的说法错误的是

A. 该过程属于物理变化
B. 该过程可应用于海水淡化
C. “筛掉”氯化钠过程类似于过滤操作
D. “筛掉”氯化钠后的海水溶质质量分数增大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室常用的实验装置,请回答有关问题:
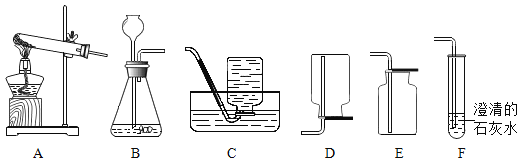
(1)装置C由导管、_____和_____(填仪器的名称)组成。
(2)实验室用H2O2和MnO2制取O2的化学方程式为_____,选用的发生与收集装置是_____(填序号,下同);若用KClO3和MnO2制取O2时,则选用的发生装置是_____。
(3)实验室制取CO2的化学方程式为_____。若制得的CO2中混有HCl和H2O,提纯时用NaOH固体除去杂质,你认为这种方法_____(填“可行”或“不可行”),理由是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常利用以下装置完成气体制备及性质实验。请回答:
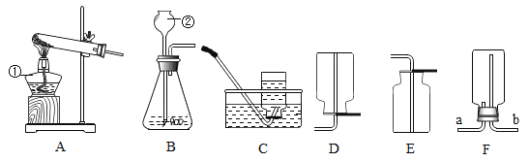
(1)指出编号仪器的名称:①_____②_____。
(2)以上_____(从A-E中选择)装置有一处明显的错误,请加以改正_____。利用改正后的装置继续完成后面的实验。
(3)用高锰酸钾制取氧气,应选择的发生装置是_____(填字母),为防止高锰酸钾粉末进入导管,应采取的措施是_____;请简述如何组装一套给试管里的固体加热的装置_____。
(4)在实验室制取二氧化碳气体,其反应原理用化学方程式表示为_____,将药品加入装置前,应先进行的操作是_____。若用F装置收集二氧化碳,验满的方法是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室用如图所示装置制取氧气,下列实验操作正确的是
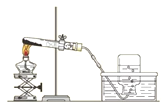
A. 收集O2后,将集气瓶移出水槽,然后盖上玻璃片
B. 先将导管口移入集气瓶,再开始加热
C. 停止加热时,先熄灭酒精灯,再移出导气管
D. 加热前,将集气瓶注满水,用玻璃片盖着倒立在盛水的水槽中
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】16g某纯净物跟氧气进行充分的燃烧后,生成44g二氧化碳和36g水,请回答以下问题。
(1)参加反应的氧气的质量是_______
(2)该物质中一定含有____________两种元素。
(3)该物质中各元素的质量比为_______
(4)该物质最可能的化学式是_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com