某发电厂处理废气NO2的反应原理为CH4+2NO2═CO2+X+2H2O.
(1)X的化学式是______;NO2中氮元素的化合价为______价.
(2)CH4中碳、氢元素的质量比为______,其中碳元素的质量分数为______.
解:(1)根据反应的化学方程式CH
4+2NO
2═CO
2+X+2H
2O,反应物中碳、氢、氮、氧原子个数分别为1、4、2、4,反应后的生成物中碳、氢、氮、氧原子个数分别为1、4、0、4,根据反应前后原子种类、数目不变,则每个X分子由2个氮原子构成,则物质X的化学式为N
2.
氧元素显-2价,设NO
2中氮元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)×2=0,则x=+4价.
(2)CH
4中碳、氢元素的质量比为12:(1×4)=3:1;其中碳元素的质量分数为
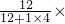
100%=75%.
故答案为:(1)N
2;+4;(2)3:1;75%.
分析:(1)由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
根据在化合物中正负化合价代数和为零,结合NO
2的化学式进行解答本题
(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,化合物中元素的质量分数=
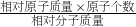
×100%,进行分析解答.
点评:本题难度不大,掌握利用化学反应前后原子守恒来确定物质的化学式、利用化合价的原则计算指定元素的化合价的方法、有关化学式的计算是正确解题的关键.

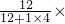 100%=75%.
100%=75%.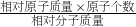 ×100%,进行分析解答.
×100%,进行分析解答.

 能源、环境问题是全球关注的热点问题.
能源、环境问题是全球关注的热点问题.