
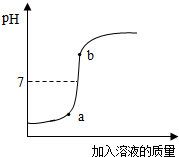
 实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数.
实验室有4%的氢氧化钠溶液200g,并用此溶液测定某盐酸溶液的溶质质量分数.| 40 |
| 20g×4% |
| 36.5 |
| 25gx |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
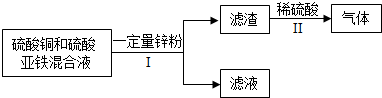
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
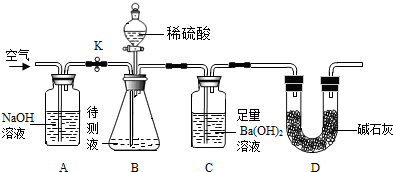
科目:初中化学 来源: 题型:
查看答案和解析>>
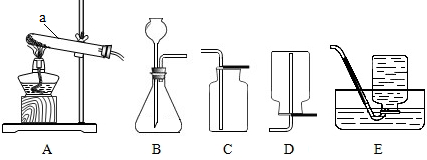
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 第22届冬季奥林匹克运动会,于2014年2月7日至23日在俄罗斯联邦索契市举行,乙基雌烯醇是一种参赛运动员禁用的兴奋剂,其化学式为C20H32O.乙基雌烯醇由
第22届冬季奥林匹克运动会,于2014年2月7日至23日在俄罗斯联邦索契市举行,乙基雌烯醇是一种参赛运动员禁用的兴奋剂,其化学式为C20H32O.乙基雌烯醇由查看答案和解析>>
科目:初中化学 来源: 题型:
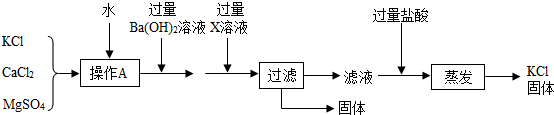
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取上述氢氧化钠固体样品加入水配成溶液,向溶液中滴加氯化钙溶液至过量,充分反应后,静置过滤. | 产生白色沉淀 | 说明久置固体中,一定含有 |
| ②取上述澄清的液体于试管,加入酚酞试液, | 酚酞试液不变色 | 说明久置固体中,一定没有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com