
| A. | 不能产生氧气 | B. | 产生氧气的速率慢 | ||
| C. | 产生氧气的总量减少 | D. | 没有氯化钾生成 |
分析 根据催化剂的特点进行分析,催化剂是指能改变其他物质的化学反应速率而本身的质量和化学性质在化学反应前后都不改变的物质.可以据此解答该题.
解答 解:根据催化剂的特点进行分析,催化剂是指能改变其他物质的化学反应速率而本身的质量和化学性质在化学反应前后都不改变的物质.
A、用氯酸钾制取氧气没有加入二氧化锰,反应的速率将会减小,但仍然会产生氧气,故A错误;
B、用氯酸钾制取氧气没有加入二氧化锰,虽然产生氧气的质量不会改变,但是反应的速率会减慢,所需的时间更长,故B正确;
C、用氯酸钾制取氧气没有加入二氧化锰,产生氧气的质量不会发生改变,故C错误;
D、用氯酸钾制取氧气没有加入二氧化锰,反应的速率将会减小,但仍然会产生氯化钾,故D错误;
故选:B.
点评 本题考查了催化剂的性质,完成此题,可以依据催化剂的特点进行.解答时要抓住“一变二不变”.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:初中化学 来源: 题型:解答题
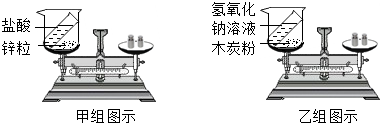
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
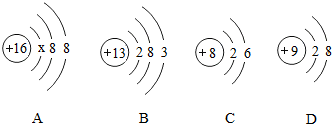
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
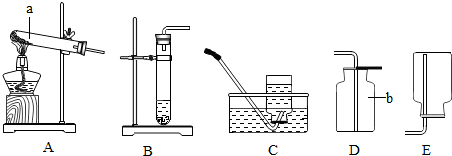
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气的组成:氮气、氧气、氢气、稀有气体等 | |
| B. | 燃烧的三个条件:可燃物、氧气、温度达到着火点 | |
| C. | 区别O2和CO2两种物质可用的方法之一是:燃着的木条 | |
| D. | 选取实验室制取气体发生装置的依据是:反应的条件和反应物的状态 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
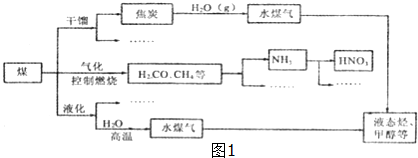
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com