
【题目】称取NaCl和Na2SO4的固体混合物28.4克,加入100克蒸馏水,完全溶解后向该混合溶液中逐滴加入208克BaCl2 溶液恰好完全反应,反应生成BaSO4 沉淀的质量与所加入的BaCl2 溶液的关系如图所示。回答下列问题:
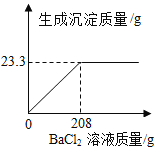
(1)完全反应后生成BaSO4沉淀______克。
(2)原固体混合物中Na2SO4的质量分数______?
(3)反应后所得溶液中溶质质量分数是多少______?(精确到0.1%)
科目:初中化学 来源: 题型:
【题目】A~H是初中常见的8种物质,它们有如图所示的转化关系。已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净的B中燃烧发出明亮的蓝紫色火焰。
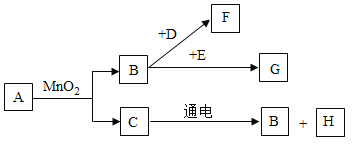
(1)请写出下列物质的化学式:G________,H________。
(2)请写出下列变化的文字表达式:
①B→F:________________,②C→B:________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】质量相等的两个烧杯中装入等质量的锌粉和铁粉,再分别放入质量相等、溶质质量分数相同的稀硫酸中,生成氢气质量(m)随反应时间(t)的变化曲线如19题图所示,下列说法错误的有( )
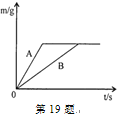
①A表示锌和稀硫酸的反应曲线
②反应结束后两种金属一定都有剩余
③两份溶液中的硫酸一定都反应完
④反应掉的锌和铁的质量比为56:65
⑤反应结束后消耗两种金属的质量相等
⑥反应结束后两烧杯中物质的质量相等
A.2个B.3个C.4个D.5个
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国是一个农业和人口大国。既要保证粮食产量,又要保护环境,因此,合理使用化肥和农药更为重要。目前农村施用的氮肥主要是尿素(CO(NH2)2)和碳酸氢铵(NH4HCO3)。据此回答以下问题:
(1)尿素是由_____元素组成的(写出元素名称)。
(2)碳酸氢铵中氮、氢、碳、氧元素的质量比为_____。
(3)尿素中氮元素的质量分数为多少?_____(写出计算过程,结果精确到0.1%)
(4)一粮农购回尿素30Kg,全部施在一秧田中,他实际给秧苗施用氮元素_____kg。若要达到同样的肥效(等质量的氮元素),改施碳酸氢铵,需要施用碳酸氢铵_____kg。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)可用于测定酒驾中的酒精(C2H5OH)含量。下列说法正确的是
A.K2Cr2O7中铬元素的化合价为+7B.K2Cr2O7属于氧化物
C.C2H5OH的相对分子质量为46D.C2H5OH中C、H、O的原子个数比为2:5:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】借助科学的化学实验方法,我们可以从不同角度正确地认识物质。
(实验一)如图所示实验可用于测定某种化肥的组成。
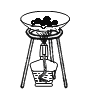
加热时,该物质会迅速分解,生成有刺激性气味的氨气(NH3)、水蒸气以及一种能使澄清石灰水变浑浊的气体。
(1)该物质是由_____组成;
(2)根据该实验,你判断该物质属于_____(填“单质”或“化合物”),这种化肥应该如何保存?_____。
(实验二)有关气体制取的研究,请根据下列装置图回答问题
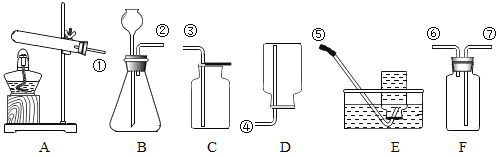
(1)实验室用氯酸钾和二氧化锰制取氧气时,可选用的发生装置是(填字母代号)_____;收集装置可用C,其原因是_____,其中二氧化锰起_____作用。用化学方程式表示氯酸钾和二氧化锰发生的反应_____。
(2)实验结束拆除装置后,发现试管炸裂,试分析造成此后果的可能原因_____(要求答出两点即可)。
(3)F装置中充满水时,可作为氧气的收集装置,则氧气应从_____(填“⑥”或“⑦”)端通入。某同学用E装置收集氧气时,集气瓶只装了一半的水,则他收集到的氧气的体积分数大约是_____。
(4)已知氢气是一种难溶于水的气体,密度比空气小。实验室用金属锌和稀硫酸在常温下制得氢气。应该选择的发生和收集装置是_____。(填字母代号)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。下表为元素周期表中部分元素的相关信息,请利用下表回答相关问题:
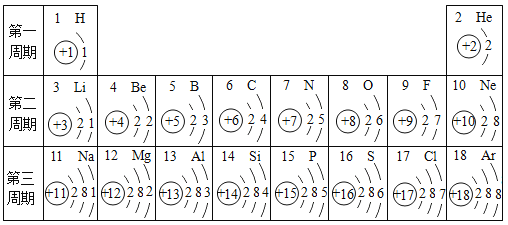
(1)硫元素的原子序数是___________,它属于_________(填“金属”成“非金属”)元素,表中氖元素位于元素周期表中的第_______周期。
(2)与元素的化学性质关系最密切的是原子的________;决定元素质量的是原子的________;硅元素和氧元素不同原因是______________。
(3)第三周期核外电子排布的规律是___________。
(4)写出核外电子排布与氖原子相同的阳离子符号是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
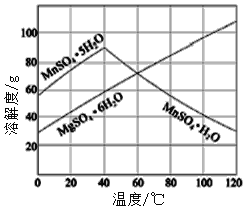
【题目】MnSO4H2O在工业、农业等方面有广泛的应用。
(一)制备:工业上用化工厂尾气中低浓度SO2与软锰矿(主要成分MnO2,杂质金属元素Mg、Al、Fe等)制备MnSO4H2O过程如下:
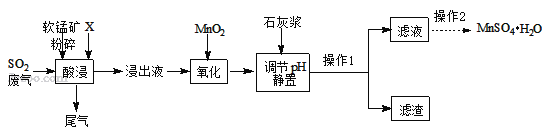
已知:浸出液中阳离子主要有H+、Mn2+、Mg2+、Fe2+、Al3+等;浸出过程中发生的主要反应化学方程式为:MnO2+SO2=MnSO4。
(1)生产中将软锰矿粉碎的目的是____。
(2)物质X最好选用_____。
a.盐酸 b.硫酸 c.硝酸
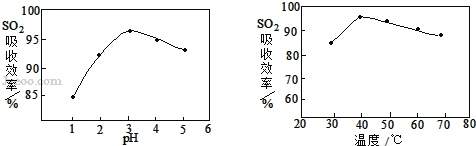
(3)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸时pH控制在____左右,温度控制在_________℃左右最适宜。
(4)流程中“氧化”步骤的目的是将Fe2+ 氧化为Fe3+,请完善反应的化学方程式MnO2+2FeSO4+_______ = MnSO4 + Fe2(SO4)3 + 2H2O 。
(5)加入石灰浆调节pH,可将氧化后的浸出液中杂质离子形成氢氧化物除去。
已知:(一)有关氢氧化物沉淀pH对应表
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
开始沉淀pH | 1.8 | 4.1 | 8.3 | 9.4 |
完全沉淀pH | 3.2 | 5.0 | 9.8 | 12.4 |
(二)Fe3+能与KSCN溶液作用显血红色则加石灰浆时应控制溶液的pH范围为_________。测定溶液的pH最好选____(a.pH试纸 b.pH计),检验Fe3+是否除尽的最佳方法是________。
(6)操作1包括过滤和洗涤,过滤用到的玻璃仪器有烧杯、玻璃棒和_____,洗涤的目的是________
(7)已知硫酸锰、硫酸镁结晶水合物的溶解度曲线如图,则操作2包括:蒸发浓缩,___________,过滤、洗涤、干燥。
(二)应用:
(8)用MnSO4可测定水中溶解氧。方法是:取100mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用0.79gL﹣1Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0mL时反应完全。有关化学反应方程式下:
①2MnSO4+O2+4NaOH=2MnO(OH)2+2Na2SO4;
②MnO(OH)2 + 2KI + 2H2SO4 = MnSO4 + K2SO4 + I2 + 3H2O;
③I2 + 2Na2S2O3 = Na2S4O6 + 2NaI。
计算水样中溶解氧的浓度(以mgL-1为单位),写出计算过程________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某钙片的标签如下,且知此钙片成分中只有碳酸钙CaCO3含有钙元素。

(1)高钙片中的“钙”应理解为 ___________(填序号)
①元素 ②原子 ③分子 ④单质
(2)维生素种类较多,其中维生素D2的化学式为C28H44O,则维生素D2的相对分子质量为_________,维生素D2中C、H、O三种元素的原子个数之比为______
(3)如果一个青少年每天需要补钙0.8克,其中0.6克都来自于牛奶,其余服用钙片。请计算每天他需要补充碳酸钙多少克?(要求有计算过程)________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com