
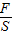 以及压强的增大实质是容器内溶液质量的改变对反应的过程进行分析解答,主要是利用溶液的增加质为放入的碳酸氢钠与生成的二氧化碳之差解决;
以及压强的增大实质是容器内溶液质量的改变对反应的过程进行分析解答,主要是利用溶液的增加质为放入的碳酸氢钠与生成的二氧化碳之差解决;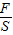 =58.8P,则有
=58.8P,则有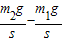 =58.8P
=58.8P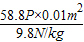 =0.06千克
=0.06千克 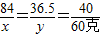
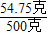 ×100%=10.95%
×100%=10.95% 

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com