
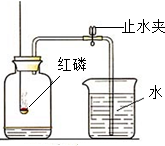
 已知空气中的主要成分是氮气和氧气.某课外活动小组设计了如图所示的测定空气中氧气的含量的实验:在燃烧匙内盛过量的红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,待红磷火焰熄灭、集气瓶冷却至室温后,再打开止水夹.请回答下列问题:
已知空气中的主要成分是氮气和氧气.某课外活动小组设计了如图所示的测定空气中氧气的含量的实验:在燃烧匙内盛过量的红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,待红磷火焰熄灭、集气瓶冷却至室温后,再打开止水夹.请回答下列问题:
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:阅读理解
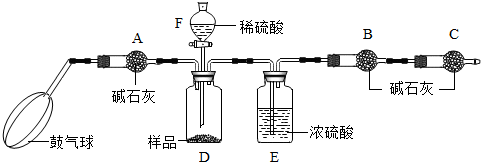
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
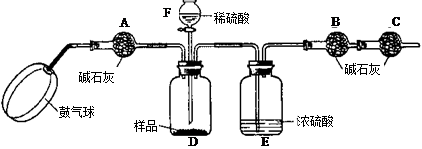
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
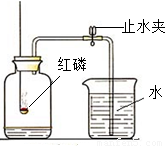
 已知空气中的主要成分是氮气和氧气.某课外活动小组设计了如图所示的测定空气中氧气的含量的实验:在燃烧匙内盛过量的红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,待红磷火焰熄灭、集气瓶冷却至室温后,再打开止水夹.请回答下列问题:
已知空气中的主要成分是氮气和氧气.某课外活动小组设计了如图所示的测定空气中氧气的含量的实验:在燃烧匙内盛过量的红磷,点燃后立即插入充满空气的集气瓶中,塞紧橡皮塞,待红磷火焰熄灭、集气瓶冷却至室温后,再打开止水夹.请回答下列问题:查看答案和解析>>
科目:初中化学 来源:2008-2009学年广东省深圳市沙井中学九年级(上)第二次月考化学试卷(A)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com