
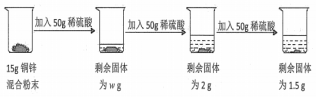
分析 根据加入两次硫酸减少为13g,而第三次依旧减少,说明每50g硫酸对应6.5g的锌反应,而第三次加入硫酸变成1.5g,说明锌已经完全反应,最后剩余为铜,且质量为1.5g.题目要求求算第一加入硫酸后得到的溶液的溶质的质量分数,要根据6.5g的锌计算生成的硫酸锌的质量和生成的氢气的质量,然后求算对应的质量分数.
解答 解:根据加入两次硫酸减少为13g,而第三次依旧减少,说明每50g硫酸对应6.5g的锌反应,而第三次加入硫酸变成1.5g,说明锌已经完全反应,最后剩余为铜,且质量为1.5g.
第一次加入50g硫酸消耗的锌的质量为6.5g.
设消耗6.5g锌生成的硫酸锌的质量为x,生成的氢气的质量为y.
Zn+H2SO4=ZnSO4+H2↑
65 161 2
6.5g x y
$\frac{65}{6.5g}$=$\frac{161}{x}$=$\frac{2}{y}$
x=16.1g
y=0.2g
所得溶液中溶质的质量分数为$\frac{16.1g}{6.5g+50g-0.2g}$×100%≈29%
答:(1)15g铜锌混合粉末中铜的质量为 1.5g.
(2)第一次加入50g稀硫酸充分反应后,所得不饱和溶液中溶质的质量分数为29%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


科目:初中化学 来源: 题型:计算题
| 物质 | M的质量/g | S的质量/g | M2S的质量/g |
| 甲 | 6.0 | 2.5 | 7.5 |
| 乙 | 7.0 | 1.5 | 7.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 ”可表示的微粒是O2(填化学符号).
”可表示的微粒是O2(填化学符号).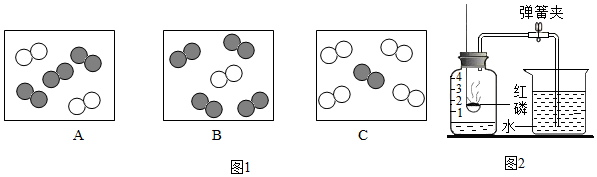
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
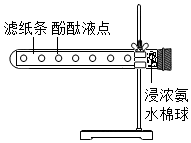 裁取一条滤纸,用玻璃棒醮取酚酞试液,在滤纸上均匀点若干液点,将滤纸塞入试管内,试管口用脱脂棉塞住.用滴管向脱脂棉上滴加适量的浓氨水,再塞上塞子,观察.(如图)
裁取一条滤纸,用玻璃棒醮取酚酞试液,在滤纸上均匀点若干液点,将滤纸塞入试管内,试管口用脱脂棉塞住.用滴管向脱脂棉上滴加适量的浓氨水,再塞上塞子,观察.(如图)查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 ”表示氮原子,“
”表示氮原子,“ ”表示氧原子.
”表示氧原子. ”可表示的微粒是氮气(填名称).
”可表示的微粒是氮气(填名称).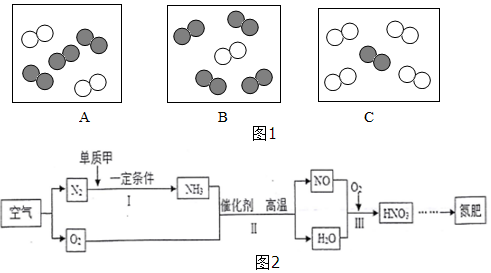
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com