解:(1)【提出猜想】盐酸过量,反应后的溶液中的溶质有剩余的盐酸和生成的氯化钙;碳酸钙过量,反应后的溶液中的溶质只有生成的氯化钙;两者刚好反应,反应后的溶液中的溶质只有生成的氯化钙;由于碳酸钙不溶于水,所以溶液中不会有碳酸钙,故猜想二不成立;
【实验探究】盐酸可与铁反应生成氢气,故溶液中加入铁粉有气泡产生,说明溶液中含有盐酸,猜想三成立;
【所以反思】①根据复分解反应发生的条件,总结出得到CaCl
2的不同途径,可以是碱和盐反应生成新碱和新盐,因此M可能是Cu(OH)
2、Fe(OH)
3、Mg(OH)
2、Zn(OH)
2、Al(OH)
3、Fe(OH)
2等难溶性碱,也可能是碱和酸反应生成盐和水,所以M还可能是H
2O;
②碱和酸或金属氧化物与酸反应生成盐和水,因此“YCl
n”属于酸;
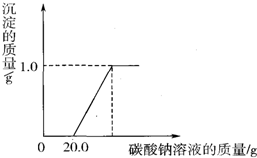
(2)①观察图象可知:废液中的氯化钙与碳酸钠最多反应生成1.0g碳酸钙
设氯化钙的质量为x,同时生成氯化钠的质量是y
Na
2CO
3+CaCl
2═CaCO
3↓+2NaCl
111 100 117
x 1.0g y
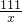
=
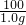
x=1.11g
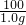
=
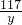
y=1.17g
②盐酸与碳酸钠反应生成氯化钠、水和二氧化碳,当加入碳酸钠溶液20.0g时,溶液中的盐酸全部参加反应,溶质为反应生成的氯化钠和溶液中未反应的物质氯化钙;
设与盐酸反应时,生成氯化钠的质量为z
Na
2CO
3+2HCl═2NaCl+CO
2↑+H
2O
106 117
20.0g×5.3% z
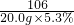
=
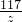
z=1.17g
当废液中两种物质刚好消耗完毕时,所得溶液中氯化钠的质量为:1.17g+1.17g=2.34g
故答案为:
(1)【提出猜想】CaCl
2;CaCO
3不溶于水;
【实验探究】三;
【实验反思】①Cu(OH)
2(合理均可);H
2O;②酸;
(2)①1.11g;②2.34g.
分析:(1)【提出猜想】根据盐酸恰好完全反应或者反应物过量进行分析;根据碳酸钙不溶于水,故猜想二不成立;
【实验探究】盐酸可与较活泼的金属反应,根据实验操作和现象得出结论;
【实验反思】①根据复分解反应发生的条件,总结出得到CaCl
2的不同途径,可以是碱和盐反应生成新碱和新盐,碱和酸反应生成盐和水;
②根据金属氧化物和酸反应生成盐和水;
(2)①根据产生沉淀的质量,结合氯化钙和碳酸钠反应方程式计算废液中氯化钙的质量;
②碳酸钠和氯化钙反应生成的碳酸钙可与盐酸反应,所以只有当废液中盐酸消耗完毕,才会有沉淀生成,故盐酸消耗了20.0g碳酸钠溶液,据此计算生成氯化钠的质量;再由沉淀质量计算生成氯化钠的质量,二者的和就是所得溶液中氯化钠的质量.
点评:本题主要考查化学反应中的物质成分的探究,解题时要结合复分解反应的原理和反应物的过量问题进行分析,此外还考查了含杂质物质的化学方程式计算和反应后溶质质量的计算,要结合反应原理和图象细致分析,难度较大.

 某研究性学习小组用石灰石(杂质不溶于水,不和盐酸反应)和稀盐酸制取二氧化碳
某研究性学习小组用石灰石(杂质不溶于水,不和盐酸反应)和稀盐酸制取二氧化碳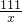 =
=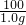 x=1.11g
x=1.11g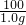 =
=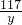 y=1.17g
y=1.17g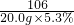 =
=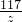


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案