
分析 铜不能和稀硫酸反应,锌和稀硫酸反应生成硫酸锌和氢气,
反应前后的质量差即为反应生成氢气的质量,根据生成氢气的质量可以计算锌的质量,进一步可以计算该合金中锌的质量分数.
解答 解:(1)生成氢气的质量为:13.00g+100g-112.8g=0.2g,
答:生成了0.2g氢气.
(2)设锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑,
65 2
x 0.2g
$\frac{65}{x}$=$\frac{2}{0.2g}$,
x=6.5g,
该合金中锌的质量分数为:$\frac{6.5g}{13.00g}$×100%=50%,
答:该合金中锌的质量分数为50%.
点评 反应前后的质量差是生成氢气的质量,只要计算出氢气的质量,再根据化学方程式就可以计算锌的质量及其质量分数了,要注意理解.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:初中化学 来源: 题型:选择题
| A. | 33.1% | B. | 53.1% | C. | 10.9% | D. | 43.3% |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
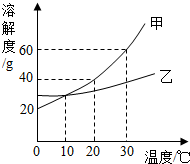 如图是甲、乙两种固体物质的溶解度曲线.请回答:
如图是甲、乙两种固体物质的溶解度曲线.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
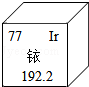
| A. | 铱元素是金属元素 | B. | 铱原子的质量为192.2 | ||
| C. | 铱原子的原子序数为77 | D. | 铱的元素符号是Ir |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学兴趣小组用如图装置探究炼铁的原理.
化学兴趣小组用如图装置探究炼铁的原理.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 物质 | 食醋 | 牛奶 | 食盐水 | 牙膏 | 肥皂水 |
| pH | 2~3 | 6~7 | 7 | 8~9 | 9~10 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com