
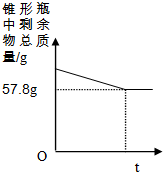
 某同学在实验室测定某石灰石样品中碳酸钙的质量分数,他取了10克样品放入锥形瓶中,另取了50克足量的稀盐酸倒入,待充分反应后,锥形瓶中剩余物总质量和时间关系如图所示,求:
某同学在实验室测定某石灰石样品中碳酸钙的质量分数,他取了10克样品放入锥形瓶中,另取了50克足量的稀盐酸倒入,待充分反应后,锥形瓶中剩余物总质量和时间关系如图所示,求:分析 根据反应时间曲线可查出碳酸钙完全反应后放出气体二氧化碳的质量,利用生成二氧化碳的质量计算出所取样品中碳酸钙质量,碳酸钙质量与样品质量比即样品中碳酸的质量分数.
解答 解:①根据质量守恒定律,因此放出气体二氧化碳的质量=10g+50g-57.8g=2.2g
②设石灰石样品中碳酸钙的质量为x,
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
$\frac{100}{x}=\frac{44}{2.2g}$
解之得 x=5g
石灰石样品中碳酸钙的质量分数=$\frac{5g}{10g}$×100%=50%.
答案:
①2.2;
②该石灰石样品中碳酸钙的质量分数是50%.
点评 准确判断图中刻度值是正确解决本题一个重要细节,是正确判断生成二氧化碳质量的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 硝酸钾在工农业生产中具有广泛用途.
硝酸钾在工农业生产中具有广泛用途.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
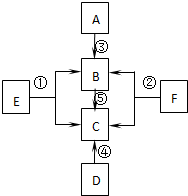 A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,它们之间的转化关系如右图所示((图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).).
A、B、C、D、E、F是初中化学常见的六种物质,其中A和B、C和D组成的元素种类相同,它们之间的转化关系如右图所示((图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,图中已略去部分物质).).查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
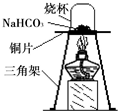 某化学兴趣小组的同学发现发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致,发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.
某化学兴趣小组的同学发现发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致,发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.| 实 验 操 作 | 预期实验现象 | 结 论 |
| 向固体中加入足量的稀盐酸 | 产生大量气泡 | 固体产物是Na2CO3,而不是NaOH. |
| 向固体中加入足量的稀盐酸 | 没有气泡产生 | 固体产物是NaOH,而不是Na2CO3. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 溶液中溶质 的质量分数 | 4% | 12% | 16% | 24% | 28% |
| 硫酸溶液的 密度/g•mL-1 | 1.02 | 1.08 | 1.11 | 1.17 | 1.20 |
| 氨水的密度 /g•mL-1 | 0.98 | 0.95 | 0.94 | 0.91 | 0.90 |
| A. | 质量分数为28%的硫酸加入等质量水,所得溶液的密度小于1.08 g•mL-1 | |
| B. | 质量分数为24%的硫酸加入等质量水,所得溶液的密度等于1.08 g•mL-1 | |
| C. | 质量分数为28%的氨水加入等质量水,所得溶液的质量分数等于14% | |
| D. | 质量分数为24%的氨水加入等质量水,所得溶液的密度等于0.95 g•mL-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com