
| A. | 1:8 | B. | 2:1 | C. | 4:5 | D. | 9:10 |
分析 设铁原子的个数为x,氧原子的个数为y,FeO分子的个数为a,Fe2O3的个数为b,由1个FeO分子、一个Fe2O3分子的构成,确定FeO、Fe2O3分子的个数比,进行分析解答.
解答 解:设铁原子的个数为x,氧原子的个数为y,FeO分子的个数为a,Fe2O3的个数为b,
则56x:16y=14:5,x:y=4:5
1个FeO分子中含有1个铁原子和1个氧原子,而一个Fe2O3分子中含有2个铁原子和3个氧原子.则(a+2b):(a+3b)=4:5,则a:b=2:1.
即该混合物中FeO的个数与Fe2O3的个数之比为2:1.
FeO的相对分子质量为56+16=72,Fe2O3的相对分子质量为56×2+16×3=160.
则FeO与Fe2O3的质量比=72a:160b=144:160=9:10.
故选:D.
点评 本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.


 口算题天天练系列答案
口算题天天练系列答案科目:初中化学 来源: 题型:选择题
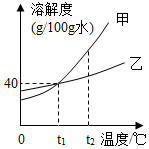 甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响,它们的溶解度曲线如图所示.下列说法正确的是( )
甲、乙两种固体均不含结晶水,在水中不发生反应且溶解性互不影响,它们的溶解度曲线如图所示.下列说法正确的是( )| A. | t1℃甲、乙的饱和溶液,降低温度,甲先析出晶体 | |
| B. | t1℃时,70g甲的饱和溶液加入40g乙物质,溶液质量仍为70g | |
| C. | 将t2℃甲、乙的饱和溶液分别降温至t1℃,析出晶体的质量:甲>乙 | |
| D. | 将t2℃等质量的甲、乙饱和溶液分别降温至t1℃,析出晶体的质量:甲>乙 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
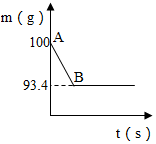 鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,将鸡蛋壳洗净、干燥并捣碎后,称取20g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,鸡蛋壳中的CaCO3和盐酸恰好完全反应.试计算(计算结果保留1位小数):
鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,将鸡蛋壳洗净、干燥并捣碎后,称取20g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,鸡蛋壳中的CaCO3和盐酸恰好完全反应.试计算(计算结果保留1位小数):查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 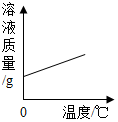 将饱和食盐水升温 | |
| B. | 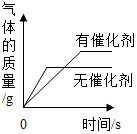 相同的两份H2O2溶液分解 | |
| C. |  一定量的锌粉与足量稀盐酸反应 | |
| D. | 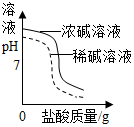 将同浓度的稀盐酸滴入等体积不同浓度的KOH溶液中 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 物质 | KCl | NH4Cl | CaCl2 | ① |
| 现象 | 继续发生反应生成二氧化碳气体,但反应较慢,反应一段时间后就趋于停止. | CaCl2溶解并生成大量的白色固体,但不能继续发生反应 | 没有明显 可见的现象 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com