
(18分)硫酸亚铁铵晶体俗名为摩尔盐,化学式为xFeSO4·y(NH4)2SO4·zH2O,在制药、电镀方面有广泛的应用。
资料: ①硫酸亚铁铵晶体易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
| 温度/℃ | FeSO4 | (NH4) 2SO4 | xFeSO4·y(NH4)2SO4·zH2O |
| 10 | 20.0 | 73 | 17.2 |
| 20 | 26.5 | 75.4 | 21. 6 |
| 30 | 32.9 | 78 | 28.1 |



(1)乳化 △
(2)Fe + H2SO4==FeSO4 + H2↑
(3)漏斗 C
(4)防止FeSO4晶体析出 Cu
(5)c a
(6)AB(漏选不给分)
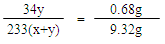
解析试题分析:(1)洗涤剂除去油污是因为它含表面活性剂,表面活性剂要使油以极小的液滴均匀悬浮在水中形成乳浊液的现象。其中的乳化剂所起的作用就叫乳化作用。
(2)操作①向铁屑中加硫酸,二者反应的化学方程式为Fe + H2SO4==FeSO4 + H2↑;
(3)过滤所需的玻璃仪器有烧杯、玻璃棒和漏斗。为了加快过滤速率,需要滤纸折叠后的表面积最大,所以应选择的折法是A;
(4)操作①中过滤时,如温度太低,硫酸亚铁的溶解度较低,其晶体会析出。所以要趁热进行。废铁屑中含一定量的铜,铜的活动性较弱不和稀硫酸反应,所以过滤后得到的固体中一定含有的物质是铜。
(5)硫酸亚铁铵晶体的溶解度较小,可通过加热浓缩而溶液浓度变大,促使形成硫酸亚铁铵的饱和溶液;然后再通过冷却结晶,使其从溶液中析出;再通过过滤分离出析出的晶体;最后洗涤干燥得到晶体。所以操作顺序是b→ c→ a →d;
(6)根据题意可知:硫酸亚铁铵晶体易溶于水,不溶于乙醇。所以操作②中使用乙醇洗涤,避免了用水洗涤所造成的晶体因溶解而损耗;且酒精易挥发,可低温晾干晶体。
【探究二】:(7)实验中生成的NH3极易溶于水,且能和水反应生成氨水,其溶液呈碱性,故能使湿润的 红色的石蕊试液变蓝;写出(NH4)2SO4与NaOH反应的化学方程式(NH4)2SO4 + 2NaOH == 2NH3 ↑+ Na2SO4 + 2H2O,此反应中(NH4)2SO4与NaOH两种反应物相互交换了成分,生成硫酸钠和氨水,氨水不稳定增长而分解为氨气和水。从类型上来说属于复分解反应;
(8)为使硫酸根完全沉淀,在实验中加入过量BaCl2溶液;
(9)洗涤沉淀是为了除去沉淀上带有的溶液中的离子,如未洗涤干净,则加入Na2SO4溶液能与过量有剩余的氯化钡反应生成沉淀。所以当加入Na2SO4溶液无沉淀生成,说明沉淀已经洗涤干净;
(10)方法一:根据题意可知:已知量为生成氨气和硫酸钡沉淀的质量;未知量为晶体中x 和y的比值。解题思路:根据质量守恒定律可知,氮、硫两元素的质量在反应前后守恒。可根据生成氨气和硫酸钡沉淀的质量计算氮、硫元素的质量比;再根据晶体的化学式计算出氮、硫元素的质量比。二者相等,可计算出晶体中x 和y的比值。具体过程如下:
生成氨气0.68g,其中含氮元素的质量为:0.68g×(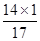 ×100%)=0.56g。
×100%)=0.56g。
生成硫酸钡9.32g,其中含钡硫元素的质量为:9.32g×(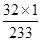 ×100%)=1.28g。
×100%)=1.28g。
根据质量守恒定律可知:氮、硫两元素在变化前后的质量相等。可列式为:
[14×2y]:[32×(x+y)] =0.56g:1.28g
则x:y=1:1
方法二:也可根据化学方程式计算此题。已知量为生成氨气和硫酸钡沉淀的质量;未知量为晶体中x 和y的比值。
xFeSO4·y(NH4)2SO4~ 2yNH3 ~ (x+y)BaSO4
34y 233(x+y)
0.68g 9.32g
34y:233(x+y)= 0.68g:9.32g
x:y=1:1
(11)根据“硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去”可知生成水的质量为7.84g—5.68g=2.16g。结合(10)中的数据及晶体的化学式[xFeSO4·y(NH4)2SO4·zH2O]可列式为:[14×2y]:[32×(x+y)]:36=0.56g:1.28g:: 2.16g 所以 x:y:z=1:1:6
(12)根据图像可知:A点到B点发生反应是失去了结晶水的质量为7.84g—6.40g=1.44g。结合(11)可知结晶水的总质量为2.16g。设A点到B点发生反应是失去了结晶水的数目为x,则可列式为:x:6=1.44g:2.16g,可解得x=4 所以反应的化学方程式为:FeSO4·(NH4)2SO4·6H2O△FeSO4·(NH4)2SO4·2H2O + 4H2O
考点:乳化作用、科学探究、综合计算、化学方程式的书写


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:初中化学 来源: 题型:计算题
“氯碱工业”是我国目前化学工业的重要支柱之一,它的主要原理是电解饱和食盐水,其化学方程式为xNaCl+2H2O xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.
xNaOH+H2↑+Cl2↑.在20℃时,取100g饱和NaCl溶液进行电解,一段时间后测得产生氯气(Cl2)的质量为7.1g.已知:20℃时,NaC1的溶解度为36g.
请分析并计算回答:
(1)运用质量守恒定律可知上述反应中x= .
(2)通过计算,上述过程中同时产生H2的质量为 g.
(3)计算电解后剩余溶液中NaC1的质量分数(写出详细的计算过程,结果精确到0.1%).
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某长期暴露在空气中的烧碱样品已部分变质,为了测定其纯度,现进行如下实验:取样品18.6g加入到85.8g水中充分搅拌至完全溶解,向所得溶液中逐滴滴加稀盐酸,产生气体的质量与所加稀盐酸质量的关系如图所示。分析题意并回答下列问题: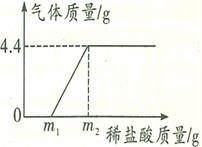
(1)反应过程中生成气体的质量是 。
(2)该烧碱样品中氢氧化钠的质量是多少克(写出规范的解题过程)?
(3)所用稀盐酸的溶质质量分数是 (用ml和m2表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
CO2和CO的混合气体3.6g与足量灼热的氧化铁充分反应后,将生成的气体全部通入80克质量分数为20%的氢氧化钠溶液中充分吸收,测得最终所得溶液的质量为84.4克,则原混合气体中CO质量为( )
| A.4.4g | B.2.8g | C. 1.4g | D.0.8g |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7分)为综合利用生产过程中的副产品CaSO4,某化工厂设计了以下制备(NH4)2SO4的工艺流程: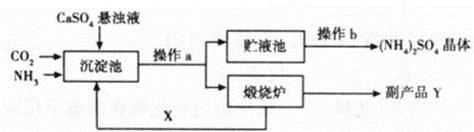
(1)此流程中,在沉淀池发生的化学反应为CO2+2NH3+CaSO4+H2O==CaCO3↓+ (NH4)2SO4
在煅烧炉中发生的化学反应方程式为 ;该工艺中可循环使用的X为 (填化学式);副产品Y有何用途 (填一种即可)。
(2)从贮液池中获得(NH4)2SO4晶体要进行操作b,操作b是 。若经过一定处理后的贮液池中,形成30℃时(NH4)2SO4的饱和溶液,则此时溶质质量分数为 (已知30℃时硫酸铵的溶解度为78g)。
(3)欲制备6.6t (NH4)2SO4晶体,理论上需要CaSO4多少吨?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
实验室有一瓶存放时间过长的氢氧化钠固体,其中一部分已转化成了碳酸钠。现需用该药品配制氢氧化钠溶液。取6克该药品,溶于13.7mL水中(水的密度为1g/cm3),然后慢慢地滴加溶质质量分数为7.4%的澄清石灰水,当用去10克澄清石灰水时,碳酸钠恰好反应完全。计算:(1)6克该药品中碳酸钠的质量;(2)滤出沉淀后所得溶液的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
小丽将铁粉和铜粉组成的7g混合物放入盛有121.6g稀盐酸的烧杯中,刚好完全反应后,烧杯内物质的总质量为128.4g。我能计算:
(1)原混合物中铁粉的质量;
(2)反应后所得溶液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)汽车尾气系统中使用催化转化器,可降低CO、NO等有毒气体的排放,其反应化学方程式为:2CO+2NO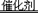 2CO2+N2,当有2.8gCO被转化时,计算同时被转化的NO的质量。
2CO2+N2,当有2.8gCO被转化时,计算同时被转化的NO的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
在盛有40g溶质质量分数为20%氢氧化钠溶液的烧杯中,用滴管吸取盐酸逐滴加入盛有氢氧化钠溶液的烧杯中,验证“中和反应会放热”,同时用pH计记录溶液pH的变化,绘制成以下函数图像。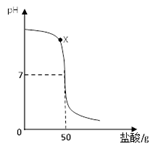
(1)用玻璃棒蘸取X点溶液,在酒精灯火焰上加热至蒸干,玻璃棒上留下的固体中一定含有 。(填化学式)
(2)为什么不能用氢氧化钠固体和稀盐酸反应验证“中和反应会放热”。 。
(3)当pH=7时,求溶液中溶质的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com