若赤铁矿石中Fe2O3的质量分数为80%,600t 这样的赤铁矿可炼出含碳等其他杂质质量分数为7%的生铁多少吨?
【答案】
分析:工业冶炼生铁的原理反应为Fe
2O
3+3CO
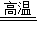
2Fe+3CO
2;根据反应中参加反应的氧化铁的质量,可计算生成铁的质量;结合生铁、赤铁矿中主要成分的含量,可计算出铁及赤铁矿的质量.
解答:解:设可炼出含杂质质量分数为7%的生铁的质量为x
Fe
2O
3+3CO
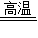
2Fe+3CO
2
160 112
600t×80% x×(1-7%)
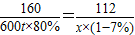
x=361t
答案:可炼出含碳等杂质质量为7%的生铁361t.
点评:在使用化学方程式进行计算时,代入化学方程式的量一定是纯净物的质量,不能把混合物的质量直接代入化学方程式进行计算.
