(2007?连云港)某研究性学习小组在综合实践活动中对某化工厂化验室排出的废水感兴趣,并对其进行了探究:
[调查获悉]废水中含有硝酸亚铁、硝酸银
[查阅资料]含硝酸亚铁的溶液呈浅绿色
[实验目的]探究用锌从废水中最大程度地回收金属银的方法;探究锌和废水中硝酸亚铁、硝酸银的反应顺序
[实验用品]废水、所需化学试剂及相关的仪器、用品
[设计方案]他们设计了如下方案:
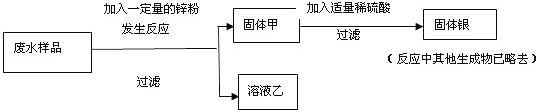
[发现问题]小组成员分别进行实验,在得到固体甲的同时发现:有些同学得到无色溶液乙,有些同学得到深浅不同的浅绿色溶液乙,小丹同学提出问题:哪种结果能最大程度地回收金属银呢?锌与废水中哪种物质先反应呢?
[讨论分析]小军同学认为:这个问题必须通过探究溶液乙或固体甲的组成才能回答,此观点得到了大家的赞同,经研究,他们决定探究溶液乙.于是他们分成两小组,第一组对无色溶液进行探究,第二组对浅绿色溶液进行探究:
(1)首先他们对溶液乙中的溶质作出了多种猜想:
第一组:①溶质为 Zn(NO
3)
2 ②溶质为 Zn(NO
3)
2、AgNO
3第二组:③溶质为 Fe(NO
3)
2和
Zn(NO3)
Zn(NO3)
④溶质为 Fe(NO
3)
2、
Zn(NO3)2
Zn(NO3)2
和
AgNO3
AgNO3
(2)小悦同学思考后指出:“通过实验或推理,都能排除第一组同学提出的猜想②,从而确立猜想①是合理的”,请你叙述其推理过程
若猜想②成立,说明Fe(NO3)2与Zn反应生成Fe,而Fe会与过滤前的溶液中AgNO3反应,即铁和AgNO3不可能都有,从而排除猜想②
若猜想②成立,说明Fe(NO3)2与Zn反应生成Fe,而Fe会与过滤前的溶液中AgNO3反应,即铁和AgNO3不可能都有,从而排除猜想②
.
(3)第二组同学经过向不同的浅绿色溶液中加入一种试剂,观察实验现象后得出结论,使③④两种猜想都得以验证.请你参与到实验操作过程中并完成下表:
| 实验操作 | 实验现象和结论 |
取少量乙溶液于试管中,
在溶液中插入一根铜丝 在溶液中插入一根铜丝 ,观察.
或者(取少量乙溶液于试管中,
滴加几滴稀盐酸(或其他氯化物溶液) 滴加几滴稀盐酸(或其他氯化物溶液) ) | 若 铜丝表面无变化 铜丝表面无变化 ,则是Zn(NO3)2、Fe(NO3)2 Zn(NO3)2、Fe(NO3)2 ,若铜丝表面有银白色固体析出 铜丝表面有银白色固体析出 则是Zn(NO3)2、Fe(NO3)2、AgNO3 Zn(NO3)2、Fe(NO3)2、AgNO3 .
或者(若溶液无明显变化 溶液无明显变化 ,则溶质是Zn(NO3)2、Fe(NO3)2 Zn(NO3)2、Fe(NO3)2 ,若溶液中有沉淀生成 溶液中有沉淀生成 ,则溶质是Zn(NO3)2、Fe(NO3)2、AgNO3 Zn(NO3)2、Fe(NO3)2、AgNO3 .) |
[交流后得出结论]
(4)当反应后溶液呈无色,溶质为
Zn(NO3)2
Zn(NO3)2
或当反应后溶液呈浅绿色,溶质为
Zn(NO3)2
Zn(NO3)2
和
Fe(NO3)2
Fe(NO3)2
时,能最大程度地回收金属银.通过探究,同学们认为:“使用过量的锌,过滤后得无色溶液”是方便、快捷并确保最大程度地回收金属银的一种方法.经过观察和思考,同学们还得出了 Zn先和废水中
AgNO3
AgNO3
反应,再和
Fe(NO3)2
Fe(NO3)2
反应的结论.
[探究后反思](5)老师评价:这种方法虽然方便、快捷,但也有不足,请你指出它的不足
浪费一些锌和稀硫酸,最好能对亚铁盐和锌盐进行回收利用,又能减少污染(或其他合理答案)
浪费一些锌和稀硫酸,最好能对亚铁盐和锌盐进行回收利用,又能减少污染(或其他合理答案)
.

 3CO2+2Fe
3CO2+2Fe

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案
 (2007?连云港)a、b两物质的溶解度曲线如图1所示,请根据图回答:
(2007?连云港)a、b两物质的溶解度曲线如图1所示,请根据图回答: