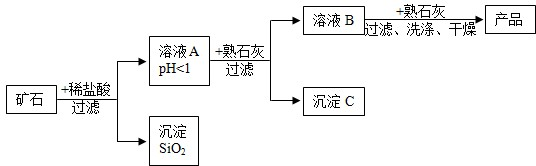
��2013?���ݣ�ʹ����ͼ��ʾװ����ȡ������
��1��д�����ȸ�������������Ļ�ѧ����ʽ��
��
��2��ָ����ͼװ����һ�����ԵIJ���֮����
�Թܿ�δ��һ����
�Թܿ�δ��һ����
��
��3�������ռ���ɺ���䴿������ƫ�ͣ�ԭ������ǣ�
BD
BD
������ĸ���ɶ�ѡ����
A����������л����˶�������
B���ռ�ǰ������ƿ��δע��ˮ
C���ռ�����ƿ����������ˮ
D��δ��������������ð��ʱ�Ϳ�ʼ�ռ�
��4�����о���������ȡ���������ʼ��䷴Ӧ�������Ĺ����У�ijͬѧ������±���ʾϵ��ʵ�飺
| ��� |
ʵ�� |
�ܷ��������� |
| A |
���ȸ������ |
�� |
| B |
���ȶ������� |
���� |
| C |
�����Ȼ��� |
���� |
| D |
����ˮ |
���� |
| E |
���ˮ |
�� |
�ٸ���ʵ��A��B��C�����Եó��Ľ����ǣ���һ�������£�
���������������ȡ����������
���������������ȡ����������
��
�ڸ���ʵ��D��E�����Եó��Ľ����ǣ�
��Ӧ����
��Ӧ����
��Ӱ�������ܷ�Ӧ������������Ҫ���أ�
��5����10g������ؼ���һ��ʱ��Ƶ�ʣ����������Ϊ9.36g���Լ��㣺
�ٲ���������������
��ʣ�������ص�������

 ��2013?���ݣ�ʹ����ͼ��ʾװ����ȡ������
��2013?���ݣ�ʹ����ͼ��ʾװ����ȡ������

 �����Ļ������������������ϵ�д�
�����Ļ������������������ϵ�д�