
分析 (1)溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量;溶解度定义中的四要素:一定温度、100g溶剂、溶液达到饱和状态、溶解的质量及单位克.
(2)根据20℃时,氯化钠的溶解度为36g,结合其含义判断配制20℃时饱和溶液68g,所需氯化钠和水的质量.
解答 解:(1)20℃时,氯化钠的溶解度为36g,20℃时氯化钠的溶解度是36g,其涵义是20℃时,100g水中最多溶解36g氯化钠,溶液达到饱和状态,则20℃时,饱和氯化钠溶液中,溶质、溶剂与溶液的质量比为36g:100g:136g=9:25:34.
(2)20℃时,氯化钠的溶解度为36g,20℃时氯化钠的溶解度是36g,其涵义是20℃时,100g水中最多溶解36g氯化钠,溶液达到饱和状态,形成饱和溶液136g;若要配制20℃时饱和溶液68g,设需要氯化钠的质量为x,则
$\frac{36g}{136g}$=$\frac{x}{68g}$ x=18g.
需要水的质量为68g-18g=50g.
故答案为:(1)9:25:34;(2)18g;50g.
点评 本题难度不大,理解溶解度的概念,熟记溶解度的四要素(温度、100g溶剂、饱和状态、单位是克)是正确解答本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
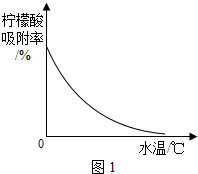
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | … |
| 溶解度/g | 96 | 118 | 146 | 183 | 216 | … |
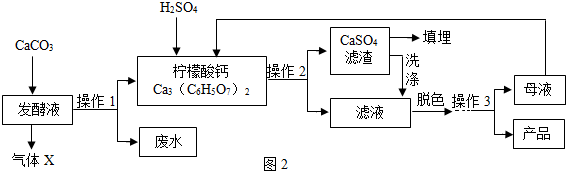
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 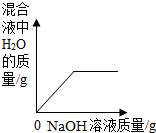 向一定量稀H2SO4中加入NaOH溶液 向一定量稀H2SO4中加入NaOH溶液 | |
| B. | 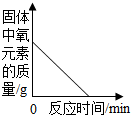 用酒精灯加热一定量KMnO4固体 用酒精灯加热一定量KMnO4固体 | |
| C. | 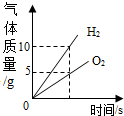 将水通电电解一段时间 将水通电电解一段时间 | |
| D. | 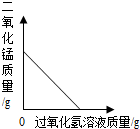 向一定量的二氧化锰中加入H2O2溶液 向一定量的二氧化锰中加入H2O2溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
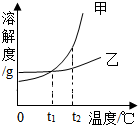 甲、乙两种物质的溶解度曲线如图所示,下列叙述正碥的是( )
甲、乙两种物质的溶解度曲线如图所示,下列叙述正碥的是( )| A. | 甲的溶解度比乙的大 | |
| B. | 将甲、乙的饱和溶液从t2℃降到t1℃析出甲的质量大 | |
| C. | 将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法 | |
| D. | t1℃时,甲和乙的饱和溶液各100g,其溶质的质量一定相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 生铁和钢都是铁的合金 | |
| B. | 铁矿石在地壳中含量最丰富,可以随意开采 | |
| C. | 银的导电性比铜强,所以一般用银作电线 | |
| D. | 废旧电池随意丢弃,不会对环境造成污染 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:推断题
| 双氧水的质量 | 双氧水的浓度 | MmO2的质量 | 相同时间内产生O2体积 | |
| Ⅰ | 50.0g | 1% | 0.1g | 9mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31mL |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com