
 已知:AlCl3+3NaOH=Al(OH)3↓+3NaCl.氢氧化钠溶液过量又发生反应:
已知:AlCl3+3NaOH=Al(OH)3↓+3NaCl.氢氧化钠溶液过量又发生反应:分析 向其中逐滴加入40%的氢氧化钠溶液时,氢氧化钠和氯化铝反应生成白色沉淀氢氧化铝和氯化钠,当氯化铝完全和氢氧化钠反应后,继续加入氢氧化钠溶液时,氢氧化铝逐渐溶解;
根据反应的化学方程式和提供的数据可以进行相关方面的计算.
解答 解:(1)向其中逐滴加入40%的氢氧化钠溶液时,能够观察到先产生白色沉淀,后沉淀溶解.
故填:先产生白色沉淀,后沉淀溶解.
(2)设氯化铝质量为x,反应的氢氧化钠质量为m,溶解沉淀所消耗NaOH溶液的质量为y,
AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,
133.5 120 78 78 40
x m 15.6g 15.6g y
$\frac{133.5}{x}$=$\frac{120}{m}$=$\frac{78}{15.6g}$,$\frac{78}{15.6g}$=$\frac{40}{y}$,
x=26.7g,m=24g,y=8g,
原混合物中NaCl的质量分数为:$\frac{30g-26.7g}{30g}$×100%=11%,
溶解沉淀所消耗NaOH溶液的质量为:8g÷40%=20g,
答:原混合物中NaCl的质量分数和溶解沉淀所消耗NaOH溶液的质量分别是11%、20g.
(3)产生15.6g沉淀时消耗氢氧化钠溶液质量为:24g÷40%=60g,
沉淀的质量(纵坐标)与所加入氢氧化钠溶液质量(横坐标)的关系图如下所示: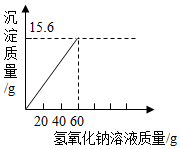
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 单质:金刚石、水银、钢 | B. | 碱:烧碱、纯碱、熟石灰 | ||
| C. | 氧化物:水、干冰、过氧化钠 | D. | 酸:硫酸、硝酸、碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用小苏打焙制糕点 | B. | 油锅中的油着火用锅盖盖灭 | ||
| C. | 冬天用煤取暖时封闭门窗 | D. | 用过的菜刀用抹布擦干放置防生锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 构建知识网络是一种重要的学习方法.如图是关于铁化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为红色固体单质.请回答下列问题:
构建知识网络是一种重要的学习方法.如图是关于铁化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为红色固体单质.请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com