
| A. | FeCl3 | B. | CuSO4 | C. | FeCl2 | D. | HgCl |
分析 利用金属活动性顺序回答.排在氢前面的金属能与酸反应生成盐和氢气,氢后面的金属不与酸反应,铁和酸反应生成亚铁盐,不能生成正三价的铁盐.
解答 解:A、在金属活动性顺序中,铁排在氢的前面,铁和盐酸反应生成氯化亚铁,不能生成氯化铁,故A不符合题意;
B、在金属活动性顺序中,铜排在氢的后面,铜不能和硫酸反应生成硫酸铜,故B符不合题意;
C、在金属活动性顺序中,铁排在氢的前面,能用铁和盐酸反应制的氯化亚铁,故C符合题意;
D、在金属活动性顺序中,汞排在氢的后面,汞不能与盐酸反应制的氯化汞,故D不符合题意.
故选C.
点评 金属与酸反应生成氢气,这里的酸一般是用盐酸和稀硫酸,不能用浓硫酸和硝酸,因为它们有强氧化性,与金属反应不生成氢气.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Mg,Al | B. | Fe,Zn | C. | Mg,Cu | D. | Fe,Cu |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 预期的实验现象 | 结论 |
| ①用磁铁充分接触滤纸上的脱氧剂粉末; ②将红色物质放入小试管中,加入足量稀硫酸观察现象.继续滴加足量的NaOH溶液. | 绝大部分黑色粉末被吸引 红色物质溶解,溶液呈黄色,产生红褐色沉淀 | 脱氧剂的成分是铁粉 红色物质是Fe203 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

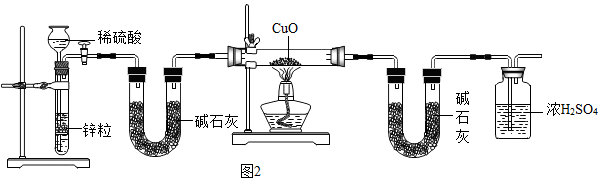
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com