
科目:初中化学 来源: 题型:阅读理解
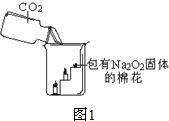 25、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.
25、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.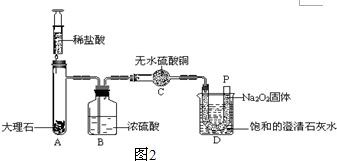
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
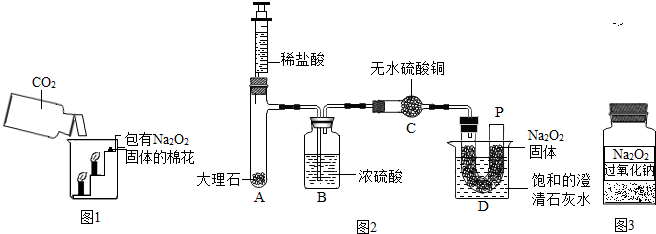
| 实验步骤 | 实验现象 |
| ①取15g变质粉末于一支大试管内,加入适量的水,共收集到1.6g气体,然后用带火星木条检验生成的气体. | 固体完全溶解,有气泡产生,带火星的小木条复燃 |
| ②继续向上述试管中加入足量的石灰水,充分反应. | 有白色沉淀生成 |
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体5g. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
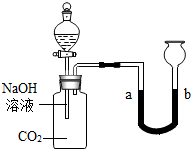 (2013?顺义区一模)化学小组的同学用如图所示的装置探究二氧化碳的性质后,觉得探究很有意思,想继续探究.
(2013?顺义区一模)化学小组的同学用如图所示的装置探究二氧化碳的性质后,觉得探究很有意思,想继续探究.| NaHCO3溶液 | NaOH溶液, | Na2CO3溶液 | |
| 加入稀盐酸 | 产生气泡 | 无明显变化 | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 溶液变浑浊 | 现象I |
| 加入CaCl2溶液 | 无明显变化 | 溶液变浑浊 | 溶液变浑浊 |
| 加热溶液至沸腾,将 气体通入澄清石灰水 |
澄清石灰水 变浑浊 |
澄清石灰水 无明显变化 |
澄清石灰水 无明显变化 |
| 实验步骤 | 操作 | 实验现象 | 实验结论 |
| ① | 取一定量反应后溶液放入试管中,滴加适量的CaCl2溶液. | 有沉淀产生 | |
| ② | 将步骤①所得的混合物过滤,洗涤,并将滤渣分成两部分. | ||
| ③ | 向其中一份步骤②所得固体中滴加稀盐酸. | 有气泡产生. | 原溶液中含有 Na2CO3. Na2CO3. . |
| ④ | 取另一份步骤②所得固体, 溶于水,然后向上层清液中滴加无色酚酞溶液. 溶于水,然后向上层清液中滴加无色酚酞溶液. . |
无色酚酞溶液变为红色. 无色酚酞溶液变为红色. . |
猜想1正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com