计算过程及结果保留到小数点后两位.
有一包氢氧化镁、碳酸镁组成的固体混合物17.04克,将该混合物放入130.00克稀盐酸中恰好完全反应,生成气体5.28克.将反应后所得溶液在1℃时恒温蒸发掉48.96克水,溶液恰好饱和.
试计算:
(1)原混合物中氢氧化镁的质量分数.
(2)反应后所得溶液中溶质的质量分数.
(3)t℃时所得饱和溶液中溶质的溶解度.
解:(1)设原混合物中MgCO
3的质量为X,与盐酸反应生成MgCl
2的质量为Y.
MgCO
3+2HCl═MgCl
2+H
2O+CO
2↑
84 95 44
X Y 5.28g

═

得:X=10.08克
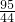
═
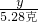
得:Y=11.4克
∴原混合物中Mg(OH)
2的质量=(17.04g-10.08g)=6.96g
∴原混合物中氢氧化镁的质量分数=
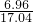
×100%═40.85%.
(2)设Mg(OH)
2与盐酸反应生成MgCl
2的质量为Z.
Mg(OH)
2+2HCl═MgCl
2+2H
2O
58 95
6.96克 Z

═

得:Z=11.4克
∴反应后所得溶液的质量=17.04+130.00克-5.28克=141.76克
∴反应后所得溶液中溶质的质量=11.40克+11.40克=22.80克
∴则反应后所得溶液中溶质的质量分数为=

×100%═16.08%.
(3)根据题目信息可知,蒸发48.96克水后溶液的质量=141.76-48.96=92.8克,溶质的质量是22.80克,此时溶液达到饱和状态.设t℃时,100克水里溶解MgCl
2达到饱和状态时的质量为S.
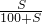
═

得:S=32.57克.
答:原混合物中氢氧化镁的质量分数为40.85%;反应后所得溶液中溶质的质量分数为16.08%;t℃时所得饱和溶液中溶质的溶解度是32.57克.
分析:(1)根据题目信息可知,气体是二氧化碳,把二氧化碳的质量代入计算出碳酸镁的质量和氯化镁的质量.
(2)先算出氢氧化镁的质量,然后代入数据计算出氯化镁的质量,最后算出溶液中溶质的质量分数.
(3)根据溶解度的概念列出关系式并计算即可.
点评:掌握化学方程式的计算格式和规范性,这个题的关键点有两个,①知道气体是二氧化碳,②会利用溶解度的概念列关系式.

 ═
═
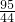 ═
═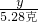
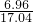 ×100%═40.85%.
×100%═40.85%. ═
═
 ×100%═16.08%.
×100%═16.08%.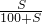 ═
═


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案