


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2013?常州)使用如图所示装置制取氧气.
(2013?常州)使用如图所示装置制取氧气.
| ||
| ||
| 序号 | 实验 | 能否生成氧气 |
| A | 加热高锰酸钾 | 能 |
| B | 加热二氧化硅 | 不能 |
| C | 加热氯化钠 | 不能 |
| D | 加热水 | 不能 |
| E | 电解水 | 能 |
查看答案和解析>>
科目:初中化学 来源: 题型:
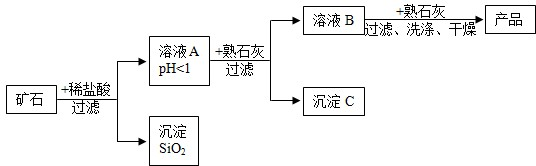
| 氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 4.2 | 8.6 |
| 完全沉淀的pH | 3.2 | 6.7 | 11.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 步骤 | 实验操作 | 实验现象 |
| ① | 取样于试管中,加足量蒸馏水,振荡 | 样品消失,得到无色澄清溶液 |
| ② | 向步骤①所得溶液中滴加无色酚酞试液 | 溶液变红 |
| ③ | 向步骤②所得溶液中滴加稀盐酸至过量 | 产生无色、无气温的气体,溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com