(2010?安徽)向50.0g 8.O%的氢氧化钠溶液中加入一定量的稀硫酸恰好完全反应,此时溶液pH=7.
(1)求反应前氢氧化钠溶液中溶质的质量;
(2)求反应后生成硫酸钠的质量.
【答案】
分析:(1)根据“溶液质量×溶质质量分数=溶液中溶质的质量”就可计算出反应前氢氧化钠溶液中溶质的质量;
(2)根据氢氧化钠与硫酸反应的化学方程式和参与反应的NaOH的质量,列出比例式,就可计算出反应后生成硫酸钠的质量.
解答:解:(1)反应前氢氧化钠溶液中溶质的质量=50.0g×8.0%=4.0g;
(2)设反应后生成硫酸钠的质量为x,
2NaOH+H
2SO
4═Na
2SO
4+2H
2O
80 98 142
4.0g x
∴
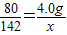
,
解之得:x=7.1g.
答:(1)反应前氢氧化钠溶液中溶质的质量为4.0g;
(2)反应后生成硫酸钠的质量为7.1g.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

 ,
,

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案