
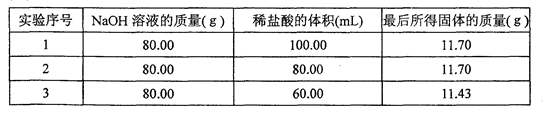
 ×100%≈52.47%
×100%≈52.47%

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| A.含钙、锌、铜、铁、硒等微量元素 |
| B.是由无机物和有机物等组成的混合物 |
| C.蛋壳焙干研粉,胃病患者服用,有止痛和治疗胃酸过多的效果 |
| D.可以加工成乳酸钙、葡萄糖酸钙等产品,变废为宝 |

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 实验操作 | 实验现象 | 实验结论 |
| (1)取样,溶于适量的水 | 形成无色溶液 | 猜想 不成立 |
| (2)取少量品尝 | 有苦涩味 | 不是 |
| (3)向(1)的溶液中滴加酚酞试液 | 溶液变红 | 是纯碱 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

| | 空烧杯 | 加入硫酸后 | 加入合金后 5分钟 | 加入合金后 10分钟 | 加入合金后 30分钟 |
| 读数(g) | 21.3 | 169.7 | 184.6 | 184.3 | 184.3 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

 Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。
Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com