
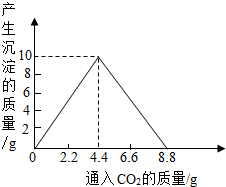
 已知CaCO3+H2O+CO2=Ca(HCO3)2,Ca(HCO3)2易溶于水.某实验小组在含一定量Ca(OH)2的石灰水中通入CO2,产生沉淀的量与通入CO2气体的量的关系如图所示,回答下列问题:
已知CaCO3+H2O+CO2=Ca(HCO3)2,Ca(HCO3)2易溶于水.某实验小组在含一定量Ca(OH)2的石灰水中通入CO2,产生沉淀的量与通入CO2气体的量的关系如图所示,回答下列问题: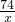 =
=


科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
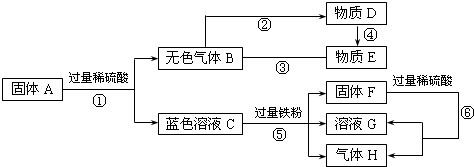
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
 (用化学方程式表示)
(用化学方程式表示)查看答案和解析>>
科目:初中化学 来源: 题型:
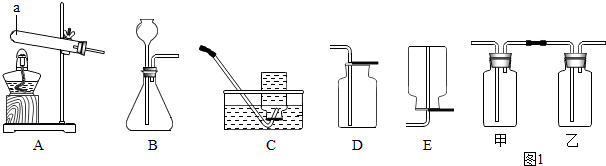
| ||
| ||
| ||
| 加热 |
查看答案和解析>>
科目:初中化学 来源: 题型:
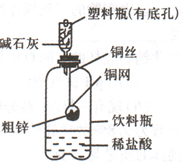 某化学兴趣小组拟用右图装置对某粗锌样品进行纯度检测.按下列实验步骤进行,请填写相关内容.
某化学兴趣小组拟用右图装置对某粗锌样品进行纯度检测.按下列实验步骤进行,请填写相关内容.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com