
 小明做红磷燃烧实验,需要氧气0.2g.(氧气密度为1.43g/L)
小明做红磷燃烧实验,需要氧气0.2g.(氧气密度为1.43g/L) 0%=92mL 92mL÷21%=438mL<666mL 不满足实验的需要.
0%=92mL 92mL÷21%=438mL<666mL 不满足实验的需要.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
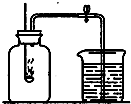 小明同学利用如图装置测定空气中氧气的含量,请你分析小明进行下列操作的理由:在带橡皮塞和导管的燃烧匙内装满红磷
小明同学利用如图装置测定空气中氧气的含量,请你分析小明进行下列操作的理由:在带橡皮塞和导管的燃烧匙内装满红磷| 点燃 |
| 点燃 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 小明同学利用如图装置测定空气中氧气的含量,请你分析小明进行下列操作的理由:在带橡皮塞和导管的燃烧匙内装满红磷________,将胶管上的止水夹夹紧,把燃烧匙内的红磷放在酒精灯火焰上点燃,并迅速伸入集气瓶内________,塞紧橡皮塞,________.
小明同学利用如图装置测定空气中氧气的含量,请你分析小明进行下列操作的理由:在带橡皮塞和导管的燃烧匙内装满红磷________,将胶管上的止水夹夹紧,把燃烧匙内的红磷放在酒精灯火焰上点燃,并迅速伸入集气瓶内________,塞紧橡皮塞,________.查看答案和解析>>
科目:初中化学 来源:2009-2010学年重庆一中九年级(上)月考化学试卷(10月份)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com