
分析 (1)根据碱的构成可知,碱是由金属阳离子和氢氧根离子构成的来解答;
(2)根据化学方程式结合硫酸钠和硫酸钡的质量关系计算即可;
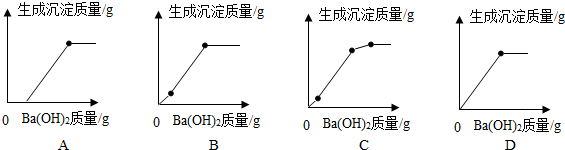
(3)很据反应的先后顺序可知,有少量硝酸的MgSO4溶液中加入Ba(OH)2后,Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-先跟硝酸中的H+发生中和反应,待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀来分析解答.
解答 解:(1)因NaOH是由钠离子和氢氧根离子构成,Ba(OH)2是由钡离子和氢氧根离子构成,其它物质构成中不符合碱的概念,则①②是碱溶液,故答案为:①②;
(2)设需要20%的硫酸钠溶液的质量是x,
Ba(OH)2+Na2SO4=BaSO4+2NaOH
142 233
20%x 116.5g
$\frac{142}{20%x}=\frac{233}{116.5g}$,
解得x=355g
答:设需要20%的硫酸钠溶液的质量是355克;
(3)因含少量硝酸的MgSO4溶液中加入Ba(OH)2后,Ba2+与溶液中的SO42-反应生成既不溶于水又不溶于酸的BaSO4沉淀,OH-先跟硝酸中的H+发生中和反应.待H+完全反应,OH-与Mg2+开始生成Mg(OH)2沉淀,即第一段沉淀是BaSO4,生成BaSO4的同时OH-和H+完全反应,产生水;(第一阶段,在硫酸根离子减少的同时,镁离子没有减少,此时由于是酸性环境,所以不能生成氢氧化镁沉淀).第二段斜率很大,是因为氢离子完全反应后,溶液中仍含有SO42-,同时还有 Ba(OH)2同时和MgSO4反应生成沉淀BaSO4和Mg(OH)2,所以沉淀多;(第二阶段由于加入的氢氧化钡和硫酸镁是正好成比例反应,导致第一阶段相对剩余的镁离子还是依旧剩余).第三段斜率又变小,溶液中SO42-反应完全,只有显得偏多的Mg2+与OH-生成Mg(OH)2沉淀,
直至曲线平直Ba(OH)2过量不再产生沉淀,故答案为:C.
点评 本题难度较大,考查化学反应与图象的对应关系,明确反应的先后顺序及每段对应的化学反应时解答的关键,还应关注曲线的起点、折点及趋势的特殊意义及不同段曲线的斜率来解答.


科目:初中化学 来源: 题型:选择题
| A. | 沸点为-42.1℃,易液化 | B. | 微溶于水,可溶于乙醇 | ||
| C. | 着火点为450℃,易燃 | D. | 无色气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaCl BaCl2 Na2CO3 | B. | NaOH HNO3 NH4NO3 | ||
| C. | H2SO4 FeCl3 NaNO3 | D. | KNO3 Na2SO4 NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | b-c-a-d-e-f | B. | c-b-a-d-e-f | C. | b-c-a-d-f-e | D. | c-b-a-d-f-e |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com