
| 选项 | 实验目的 | 实验操作 |
| A. | 鉴别蒸馏水 | 观察颜色 |
| B. | 比较Fe、Cu、Ag的金属活动性 | 铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |
| C. | 除去CO2气体中的CO | 点燃 |
| D. | 鉴别硬水和软水 | 肥皂水 |
分析 蒸馏水、氯化钠溶液等都是无色的;
铁比铜活泼,铜比银活泼;
二氧化碳不能支持燃烧;
利用肥皂水可以区分硬水和软水.
解答 解:A、因为多种液体的颜色是无色的,因此不能通过观察颜色鉴别蒸馏水;
B、铁丝浸入CuSO4溶液中时,铁丝表面附着了一层红色固体,说明铁比铜活泼,铜丝浸入AgNO3溶液中时,铜丝表面附着了一层银白色固体,说明铜比银活泼,因此可以比较Fe、Cu、Ag的金属活动性;
C、二氧化碳不支持燃烧,因此不能用点燃的方法除去二氧化碳中的一氧化碳;
D、向水中加入肥皂水时,如果产生的泡沫较多,是软水,如果产生大量浮渣,是硬水,因此可以用肥皂水鉴别硬水和软水.
故选:B;
故填:肥皂水.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
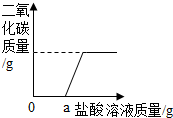 一瓶久置的氢氧化钠固体已经发生了变质.某研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和 Na2CO3的混合物;可能全部变质,固体是Na2CO3.
一瓶久置的氢氧化钠固体已经发生了变质.某研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和 Na2CO3的混合物;可能全部变质,固体是Na2CO3.| 样品质量 | 反应前总质量 | 反应后总质量 |
| 10.6克 | 148.5克 | 146.3克 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 NaOH是化学实验中常用的试剂.
NaOH是化学实验中常用的试剂. 查看答案和解析>>
科目:初中化学 来源: 题型:解答题
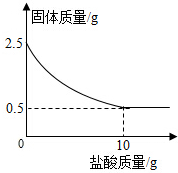 测定石灰石中的碳酸钙的含量,取出2.5克石灰石样品,逐渐加入稀盐酸,充分反应后测得剩余固体质量与加入稀盐酸的质量关系如图所示.
测定石灰石中的碳酸钙的含量,取出2.5克石灰石样品,逐渐加入稀盐酸,充分反应后测得剩余固体质量与加入稀盐酸的质量关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 侯德榜是我国化学工业的奠基人,纯碱工业的创始人,他发明的“侯氏制碱法”,缩短了生产流程,减少了对环境的污染,在人类化学工业史上写下了光辉的一页,侯氏制碱法的主要反应为:NH2+CO2+H2O+NaCl═NaHCO3+NH4Cl,他利用生成物中的NaHCO3溶解度较小,一经生成便会大量析出,能够很容易的分离出NaHCO3.化学小组同学模拟“侯氏制碱法”完成以下实验:10℃时,向92.6g饱和溶液中先通入足量NH3共3.4g,再通入一定量CO2至恰好完全反应,请计算:(不考虑溶解在溶液中的NH3和CO2的质量)
侯德榜是我国化学工业的奠基人,纯碱工业的创始人,他发明的“侯氏制碱法”,缩短了生产流程,减少了对环境的污染,在人类化学工业史上写下了光辉的一页,侯氏制碱法的主要反应为:NH2+CO2+H2O+NaCl═NaHCO3+NH4Cl,他利用生成物中的NaHCO3溶解度较小,一经生成便会大量析出,能够很容易的分离出NaHCO3.化学小组同学模拟“侯氏制碱法”完成以下实验:10℃时,向92.6g饱和溶液中先通入足量NH3共3.4g,再通入一定量CO2至恰好完全反应,请计算:(不考虑溶解在溶液中的NH3和CO2的质量)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com