
����Ŀ����7����ϡ����������������Һ���û����������Ϊ֤���������������Ʒ����˻�ѧ��Ӧ��Сӱͬѧ����������̽����
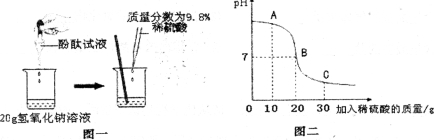
��1��Сӱͬѧͨ��ͼһ��ʾ��ʵ�飬֤���������������Ʒ����˻�ѧ��Ӧ�������ݵ�ʵ�������� ��
��2������������ʵ���ҳ���ҩƷ����������˵���У���ȷ���� �����������
A���������ɽ�NaOH����ֱ�ӷ�����ƽ������̵�ֽ�Ͻ��г���
B���ܽ⣺NaOH��������ˮʱ�ų������ȣ��ܽ�ʱ���ò��������Ͻ���
C��Ӧ�������ô���ˮ��ϴƤ���ϵ�NaOH��Һ����Ϳ��3%��5%ϡ������Һ
D�����棺NaOH���������տ����е�ˮ������C02��Ӧ�ܷⱣ��
��3����Һ��pH�仯��������ϡ�����������ϵ��ͼ����ʾ��ͼ��A���Ӧ��Һ�е�������________��д��ѧʽ����
��4��������ʾ��Ϣ������Һǡ��Ϊ����ʱ�������ò�������Һ�����ʵ������� (���Ƶμӵķ�̪��Һ���������㾫ȷ��0.0lg��
���𰸡���1����Һ�ɺ�ɫ��Ϊ��ɫ ��2��BD ��3��NaOH�� Na2SO4 ��4��2.84g
��������
�����������1��֤���������������Ʒ����˻�ѧ��Ӧ�����ݵ�ʵ����������Һ�ɺ�ɫ��Ϊ��ɫ ��2����2������������ʵ���ҳ���ҩƷ�������й�˵���У���ȷ����B NaOH��������ˮʱ�ų������ȣ��ܽ�ʱ���ò��������Ͻ��裻D���棺NaOH���������տ����е�ˮ������C02��Ӧ�ܷⱣ����3��A�㴦Ϊ��ʣ���������ʶ�Ӧ��Һ�е�������NaOH�� Na2SO4
��4���⣺ H2SO4 ���� = 20g �� 9.8% = 1.96 g �� 1 ����
�� Na2SO4 ����Ϊ x�� ��
H2SO4 + 2NaOH = Na2SO4 + 2H2O �� 1 ����
98 142
1.96g x
![]() �� 1 �������� x = 2.84g �� 1 ����
�� 1 �������� x = 2.84g �� 1 ����
�� ������Һ�к��� 2.84g Na2SO4 ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����6�֣�ij�����ۺϼӹ���ˮ����Ҫ������ͼ��ʾ��

�����ͼʾ�ش��������⣺
��1������I��������_______________��
��2���Լ�1��___________________��д��ѧʽ����ͬ������ɫ����D��____________��
��3����ҺB�к��е�������__________________________������ҺB�����Լ�2������Һ�пɹ۲쵽_______________________________������
��4��������״̬�µ����ˮ�Ȼ�þ�����һ�ֽ������ʺ�һ��˫ԭ�ӷ��ӵ����嵥�ʣ��÷�Ӧ�Ļ�ѧ����ʽ��__________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������Ϊ�˷�ֹ�¹ʷ���������Ҫ��ȡһЩ��ȫ��ʩ�����д�ʩ��������
A���Ͻ��ÿ�Я����ȼ���ױ���Ʒ�˳�
B���˾��������������豸����������ͨ��
C��ҹ������ú��й©�������Ƽ��
D������վ����۳������Ͻ��̻�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(2��)������(R)��ϩ��(��ѧʽΪC3H6O2)��ɳ����˹����Ӧ�ò��Գƺϳɼ����ϳɵ�һ����Ҫ���ʡ���������������һ���������ಡ��ҩ����㣺
��1��C3H6O2 �е�̼���⡢������Ԫ�ص������� ��
��2��C3H6O2 ��̼Ԫ�ص��������� ��(��ȷ��0.1%)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ÿ��ͨ����ȡʳ�ﲻ�ϲ�������Ҫ�ĸ���Ԫ�أ�����ʱҲ������ijЩ�к���Ԫ�أ������п���Ԫ�ؽ��з��࣮
���� �ڼ� ���� �ܸ� �ݹ� �� ��Ǧ ��þ ���� ��п
��1�������б������Ԫ�� ��
��2���������к�����Ԫ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����7����ijѧϰС���ͬѧ��̽��Բ������A����ɣ����п��ܺ���Na2S04��NaOH��
Ba(OH��2��BaC03��MgCl2���������е����ֻ���֡�ʵ����̺ͳ��ֵ�������ͼ��ʾ��
![]()
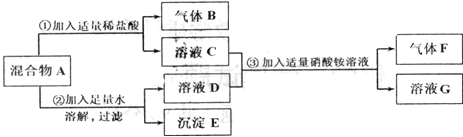
��������ʵ����̺ͷ�������������ش��������⣺
��1������F�Ļ�ѧʽ��_ ��
��2��д���������һ����������B�Ļ�ѧ����ʽ�� ����
��3������ҺC����ҺG�У�һ�������ڵ���������____ ��д���ӷ�������
��4����������A�У��϶������ڵ������� �֣�������ȷ���������� ��д��ѧʽ����
��Ҫ��һ���������Ƿ���ڣ��������ʵ�鷽������Ҫ˵��ʵ��������衢������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼���������̼�������Ļ��������ǽ��ܼ��š��������������ϡ���̼���������
A���þɱ�ֽ����Ǧ�ʸ� B��������չ��������
C���������մ��������ڷ��� D�����й�����ȼ������Ȼ����ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʲ��������������
A��Ũ���� B���������� C����ʯ�� D���Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����60����������Һ������20�棬�о����������йظù��̵�˵���������
A��60��ʱ����Һһ��������ر�����Һ
B��20 ���϶�ʱ����Һһ��������صı�����Һ
C������ص��ܽ�����¶Ƚ��Ͷ���С
D������صľ���ɲ��ý��½ᾧ�ķ����õ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com