
用来测定空气成分的方法很多,如图所示的是小明用红磷在空气中燃烧的测定方法。实验过程是:
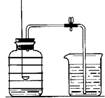
第一步:将集气瓶容积划分为五等份,并做好标记。
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧。
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,进入集气瓶中水的体积约为集气瓶总容积的1/5。请回答下列问题:
(1)上面的实验同时证明了氮气有 的化学性质。
(2)实验完毕,若进入集气瓶中水的体积不到总容积的1/5,你认为导致这一结果的原因可能是 。
(3)第二步中发生反应的文字表达式为________________________________。
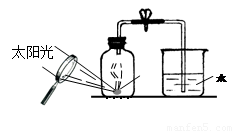
(4)某同学对实验进行反思后,提出了改进方法(如图所示 ),你认为改进后的优点是: 。

(1)不能燃烧,也不支持燃烧
(2)装置漏气 或 红磷的量不足
(3)磷 + 氧气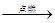 五氧化二磷 (4)装置始终密闭,空气没有逸出,实验结果准确
五氧化二磷 (4)装置始终密闭,空气没有逸出,实验结果准确
【解析】试题分析:本题是测定空气中氧气的含量,我们常用燃烧红磷或白磷的方法,因为磷燃烧生成白色固体五氧化二磷,几乎不占空间,使得内外产生气压差,从而得到正确的结论。因此在选择可燃物时,必须考虑到:燃烧的条件,生成物的状态,不与空气中其他物质发生反应。保证本实验成功的关键是:①装置气密性好;②红磷要足量;③要冷却至室温再读数。
(1)空气的主要成分是氮气和氧气,红磷燃烧消耗了氧气,因此剩余的主要是氮气。故上面的实验同时证明了氮气有不可燃、不助燃、比较稳定的化学性质。
(2)实验完毕,若进入集气瓶中水的体积不到集气瓶中原空气总体积的1/5,导致这一结果的原因可能是:红磷量不足、装置气密性不好、未冷却到室温就打开止水夹、红磷中含有能燃烧生成其他气体的杂质。
(3)磷与氧气在点燃条件下反应生成五氧化二磷,故该反应的文字表达式为:
磷 + 氧气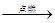 五氧化二磷。
五氧化二磷。
(4)由于在燃烧过程中释放出大量的热,导致气体的体积会膨胀,所以原有装置会在插入燃烧匙的过程中有气体逸出,所以改进装置就克服了这一点。即不需打开瓶塞点燃红磷造成装置漏气,实验误差小。
考点:测定空气里氧气含量的探究
点评:只有熟悉用红磷测定空气组成的实验原理、操作、现象、结论和注意事项,才能正确解答本题。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| ||
| 猜 想 | 简 要 实 验 方 案 | 现 象 | 结 论 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
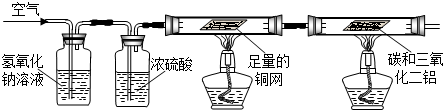
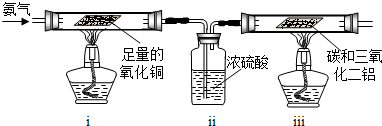
 NH3↑+CO2↑+H2O;②2NH3+H2SO4=(NH4)2SO4;③2NH3+3CuO
NH3↑+CO2↑+H2O;②2NH3+H2SO4=(NH4)2SO4;③2NH3+3CuO 3Cu+N2+3H2O;④氨气密度小于空气,极易溶于水,具有强烈的刺激性气味,是空气的污染物之一.
3Cu+N2+3H2O;④氨气密度小于空气,极易溶于水,具有强烈的刺激性气味,是空气的污染物之一.
| 猜 想 | 简 要 实 验 方 案 | 现 象 | 结 论 |
查看答案和解析>>
科目:初中化学 来源:2011年江苏省镇江市丹阳九中中考化学一模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com