
氯化铵和硝酸钾溶解度曲线如图所示,下列叙述正确的是( )
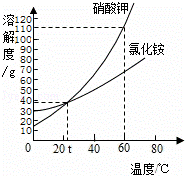
|
| A. | 60℃时,硝酸钾的溶解度小于氯化铵的溶解度 |
|
| B. | 40℃的硝酸钾饱和溶液降低温度会变为不饱和溶液 |
|
| C. | t℃时,氯化铵饱和溶液与硝酸钾饱和溶液的溶质的质量分数相等 |
|
| D. | 60℃时,100g水中加入120g硝酸钾,充分搅拌,得到的是硝酸钾不饱和溶液 |
| 固体溶解度曲线及其作用;饱和溶液和不饱和溶液;饱和溶液和不饱和溶液相互转变的方法;溶质的质量分数、溶解性和溶解度的关系.. | |
| 专题: | 压轴实验题;图表分析,寻找有效数据. |
| 分析: | 根据物质的溶解度曲线,分析判断:60℃时,两种物质的溶解度大小;根据硝酸钾溶解度随温度变化而变化的情况判断溶液是否饱和;比较两物质在同一温度时的饱和溶液中溶质的质量分数; |
| 解答: | 解:A、60℃时,硝酸钾的溶解度大于氯化铵的溶解度,故A错误. B、硝酸钾的溶解度随着温度的降低而减小,故40℃的硝酸钾饱和溶液降低温度仍为饱和溶液,故B错误. C、t℃时,氯化铵和硝酸钾两物质的溶解度相等,故氯化铵饱和溶液与硝酸钾饱和溶液的溶质的质量分数相等;故C正确. D、60℃时,硝酸钾的溶解度为110g,故100g水中加入120g硝酸钾,充分搅拌,只能溶解110g,得到的是硝酸钾的饱和溶液;故D错误. 故选C. |
| 点评: | 主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力. |


 能力评价系列答案
能力评价系列答案科目:初中化学 来源: 题型:
全世界每年因生锈损失的钢铁约占世界钢铁年产量的1/4。某学生想探究铁生锈的条件,他将干净的铁钉分别同时放入A、B、C三支试管中进行研究。
(1)请 你帮助该学生完成下列实验设计的内容:
你帮助该学生完成下列实验设计的内容:
| 编号 | 操作方法 | 实验目的 |
| A | 加热烘干试管,小心放入铁钉,塞上塞子 | 探究铁在干燥空气中的生锈情况 |
| B | 放入铁钉,注入蒸馏水浸没铁钉,并用植物油液封 |
|
| C |
| 探究铁在有空气和水时的生锈情况 |
(2)一周后,编号为 的试管中的铁钉最易生锈。
(3)用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在南方比安装在北方更易生锈,其原因是: 。
(4)在焊接铁管时,为了使接口更加牢固,常用稀盐酸清洗接口处的铁锈,该反应的化学方程式为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
除去下列物质中的杂质,所用的试剂和方法不正确的是( )
A.除去二氧化碳中混有的 一氧化碳可以用点燃的方法
一氧化碳可以用点燃的方法
B .除去氯化钾中混有的二氧化锰可以用溶解、过滤、蒸发的方法
.除去氯化钾中混有的二氧化锰可以用溶解、过滤、蒸发的方法
C.除去铜粉中混有的锌粉可以用加入过量的稀盐酸、过滤、洗涤、干燥的方法
D.除去生石灰中混有的碳酸钙可以用高温煅烧的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
如果将物质按单质、氧化物、酸、碱、盐、有机物分类,如图中甲、乙、丙是三种不同类别的物质,且相连物之间均能发生化学反应,下列说法符合图示要求的是( )

|
| A. | 当甲为氯化铵时,X可以为氢氧化钾 |
|
| B. | 当甲、乙、丙分别为酸、碱、盐时,X一定不可能为碳酸钠 |
|
| C. | 当X为氧气时,甲、乙、丙可以为氢气、红磷、葡萄糖 |
|
| D. | 当X为稀盐酸时,甲、乙、丙可以为铜、氢氧化铜、硝酸银 |
查看答案和解析>>
科目:初中化学 来源: 题型:
人体缺乏维生素C可能得坏血病.维生素C的化学式是C6H8O6,在新鲜的水果、蔬菜中含量都较高.某研究性学习小组测定了某品牌橙汁的维生素C的含量,过程如下:取20.00g橙汁用含碘1.00%的碘溶液与其反应,恰好完全反应时消耗碘溶液25.40g.
试计算:该橙汁中维生素C的质量分数.(计算结果精确到0.01%)(反应的化学方程式C6H8O6+I2=C6H6O6+2HI)
查看答案和解析>>
科目:初中化学 来源: 题型:
如图是A、B、C三种物质的溶解度曲线,据图回答:
(1)P点表示t2℃时 物质的溶解度相等.
(2)溶解度随温度升高而减少的物质是 .
(3)t2℃时,三种物质的溶解度由大到小的顺序是 .
(4)t1℃时A的溶解度 t2℃时A的溶解度;(填“大于”、“小于”或“等于”,下同)
(5)t2℃时,B的饱和溶液中溶质的质量分数 A的饱和溶液中溶质的质量分数.
(6)在t2℃在三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数大小关系是 .

查看答案和解析>>
科目:初中化学 来源: 题型:
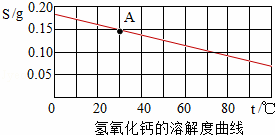
根据氢氧化钙的溶解度曲线,完成下列问题.
(1)曲线上满足A点指标的溶液在升高温度后会产生的现象是: ,此时的溶液中溶质质量分数将 (选填“变大”或“变小”或“不变”)
(2)若向曲线上满足A点指标的溶液中加入生石灰,则溶液中的溶质质量将 (选填“增加”或“减少”或“不变”)
查看答案和解析>>
科目:初中化学 来源: 题型:
水在实验室和日常生活中有很多用途。
I、溶液是日常生活中的常见物质,水是最常用的溶剂。
20℃时,将等质量的甲、乙两种固体物质,分别加入到盛有100g水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图 2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:
2,甲、乙两种物质的溶解度曲线如图3。请结合图示回答下列问题:
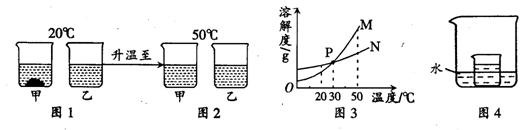
(1)图1中一定为饱和溶液的是 ▲
(2)图3中表示乙的溶解度曲线是 ▲ ;P点表示的含义是 ▲ 。
(3)在图4所示的实验中,小烧杯内盛放的是20℃时甲物质的饱和溶液。某同学要使小烧杯内有固体析出时,他应向大烧杯的水中加入下列物质中的 ▲ (填字母)。
A.氧化钙 B.氯化钠 C.氢氧化钠 D.硝酸铵
Ⅱ、水在工业生产中也很重要。
以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。电解饱和食盐水可以得到多种化工产品,主要过程如下:
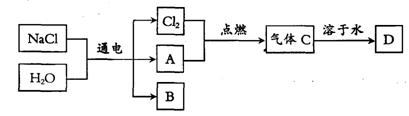
[资料 卡:石灰水中的溶质是一种碱——Ca(OH)2]
卡:石灰水中的溶质是一种碱——Ca(OH)2]
(4)已知气体A是密度最小的气体,B是一种碱,D是一种酸。写出金属铝和酸D反应生成气体A的化学方程式: ▲ 。
(5)B的化学式为 ▲ 。
(6)工业上电解食盐水是在立式隔膜电解槽中进行,产生的Cl2和气体A在两处逸出并分别收集、储存。
①已知20℃,S(NaCl)=36g,则室温下,68 kg饱和食盐水中溶质的质量为 ▲ 。
②电解一段时间,当收集到氯气的质量为0.71 kg时,列式计算生成的B的质量。
▲ 。
③0.71 kg氯气和A完全反应生成气体C,溶于一定量的水中形成酸D。若酸D中的溶质质量分数为36.5%,则其中水的质量为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com