解:根据化学方程式的计算要求可知图示的情况:解法一中氢气的相对分子质量应该是2不是1,解法二中反应的硫酸质量应该是19.6g×10%;
解法一:设生成氢气的质量为x
Zn+H
2SO
4=ZnSO
4+H
2↑
65 2
1.3g x
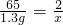
x=0.04g
答:生成氢气的质量是0.04g;
解法二:设生成氢气的质量为x
Zn+H
2SO
4=ZnSO
4+H
2↑
98 2
19.6g×10% x
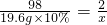
x=0.04g
答:生成氢气的质量是0.04g;
分析:根据锌与硫酸反应的化学方程式,由6.5g锌的质量计算恰好完全反应时放出氢气的质量及反应生成硫酸锌的质量,然后分别利用溶液中溶质质量分数的计算公式,求出反应后所得溶液中溶质的质量分数.
点评:此题是根据化学方程式的计算题,我们计算的依据是化学方程式,所以务必要保证我们的出发点即化学方程式要书写正确,然后再根据相对分子质量的比进行求算.




 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案