
根据已学知识,可产生CO2的反应有:①木炭在空气中燃烧;②碳还原氧化铜;③煅烧石灰石;④石灰石与稀盐酸反应;⑤铜绿受热分解;⑥大理石与稀硫酸反应;⑦碳酸钠粉末与稀硫酸反应,试评价用于制取CO2时上列各方案中较好的是( )
|
解答:方案④较好 |
|
点悟:方案①中木炭在空气中燃烧较易发生,原料也易得,但生成的CO2难收集,而且还有可能因燃烧不充分产生CO;②和③反应时都需在高温下进行,对反应条件和仪器要求较高;④中块状石灰石与液体稀盐酸接触面较小,反应速率适中,在特定装置中产生的CO2气体易收集;⑤中铜绿受热虽在较低温下利用制O2的装置即可制得CO2,但根据化学方程式:Cu2(OH)2CO3 |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:初中化学 来源: 题型:阅读理解
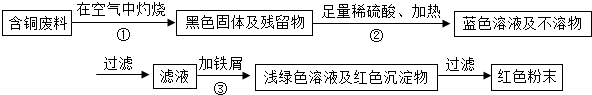
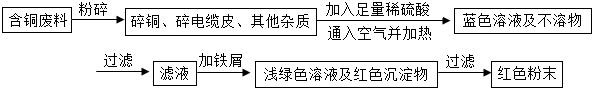
查看答案和解析>>
科目:初中化学 来源: 题型:
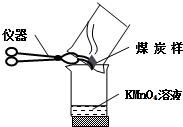 23、在我国的能源结构中,燃煤约占70%.
23、在我国的能源结构中,燃煤约占70%.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
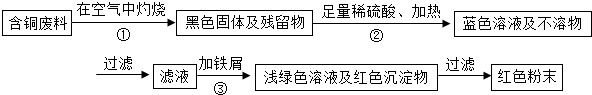
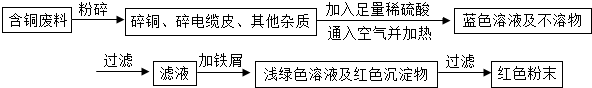
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

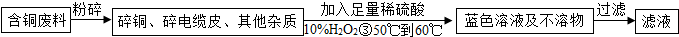
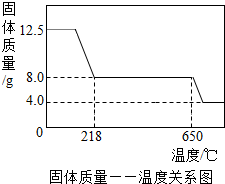
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com