
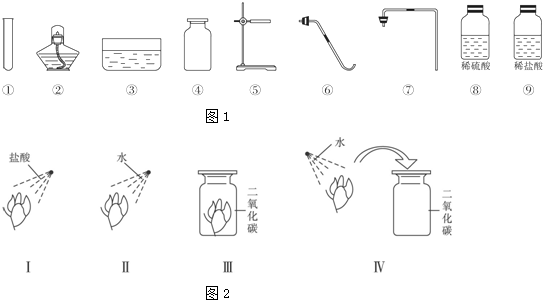
分析 (1)根据实验室制取并收集二氧化碳气体需要的仪器选择;
(2)根据实验室中制取二氧化碳的原理来分析;
(3)根据二氧化碳进行分析,酸性溶液能使紫色石蕊试液变成红色,水和二氧化碳不能使紫色石蕊试液变色.
(4)根据反应前后的质量差求出生成二氧化碳的质量,根据化学方程式可求得参加反应的碳酸钙的质量,进而可求大理石中碳酸钙的质量分数;
解答 解:(1)实验室用石灰石和稀盐酸反应,不需要加热,则从图中选出制取并收集二氧化碳气体需要的仪器是①④⑤⑦.故填:①④⑤⑦;
(2)实验室中制取二氧化碳用大理石或石灰石与稀盐酸反应,大理石或石灰石的主要成分是碳酸钙,与稀盐酸反应生成氯化钙、水和二氧化碳;故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)①稀盐酸是酸性溶液,能使石蕊试液变红,水和二氧化碳不能使石蕊试液变色,二氧化碳的水溶液能使石蕊试液变红,所以在Ⅱ中纸花不变色,在Ⅳ中纸花变红.
②盐酸使紫色石蕊试液变红,水不能使紫色石蕊试液变红,该同学进行的Ⅰ、Ⅱ两项实验,说明了酸性溶液能使石蕊变红;
③该同学进行四组对比实验的目的是:二氧化碳能与水反应生成了碳酸.
④在实验Ⅳ中二氧化碳能与水反应生成了碳酸,发生反应的化学方程式为:CO2+H2O═H2CO3.
故答案为:①纸花不变色,纸花变红;②酸性溶液能使石蕊变红;③二氧化碳能与水反应生成了碳酸;④CO2+H2O═H2CO3.
(4)①由题意可知,反应后生产二氧化碳的质量为:12g+20g-27.6g═4.4g
②设参加反应的碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{44}=\frac{x}{4.4g}$
x=10g
则大理石中碳酸钙的质量分数为$\frac{10g}{12g}$×100%≈83.3%
答:①该反应生产二氧化碳的质量是4.4g.
②大理石中碳酸钙的质量分数约为83.3%.
点评 本题主要考查探究二氧化碳与水的反应,难度不大,完成此题,可以依据已有的知识进行.此题是对化学方程式计算的考查题,利用质量守恒定律求出反应放出二氧化碳的质量是进行后面计算的基础,体现出运用知识分析问题的能力.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 S.
S.查看答案和解析>>
科目:初中化学 来源: 题型:推断题
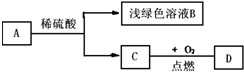 已知,A、B、C、D四种物质之间存在以下转化关系.其中C是单质,D是相对分子质量最小的氧化物.试回答:
已知,A、B、C、D四种物质之间存在以下转化关系.其中C是单质,D是相对分子质量最小的氧化物.试回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫酸铜溶液、氯化钠溶液 | B. | 硫酸亚铁溶液、稀盐酸 | ||
| C. | 氢氧化钠溶液、无色酚酞溶液 | D. | 氢氧化钠溶液、稀盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com