
| A. | Na2CO3、NH4NO3、Ca(OH)2 | B. | FeCl3、Na2SO4、Mg(NO3)2 | ||
| C. | AlC13、Ba(NO3)2、CaCl2 | D. | NH4HCO3、AgNO3、BaCl2 |
分析 根据复分解反应发生的条件可知,若物质之间相互交换成分不能生成水、气体、沉淀,则能够在溶液中大量共存,据此分析即可.
解答 解:A、因Na2CO3、NH4NO3均能与Ca(OH)2反应生成二氧化碳和水及氨气,所以不能大量共存,故A错误;
B、因该组物质相互交换成分不能生成水、气体、沉淀,则能够在溶液中大量共存,故B正确;
C、因该组物质相互交换成分不能生成水、气体、沉淀,则能够在溶液中大量共存,故C正确;
D、因BaCl2 和AgNO3能在水中相互交换成分生成硫酸钡沉淀,所以不能大量共存,故D错误;
故选BC.
点评 本题考查学生利用复分解反应发生的条件来判断物质能否共存问题,学生应熟悉复分解反应发生的条件、物质的溶解性等来解答此类习题.


科目:初中化学 来源: 题型:选择题
| A. | 只能与硫酸反应,不能与氢氧化钠反应 | |
| B. | 只能与氢氧化钠反应,不能与硫酸反应 | |
| C. | 既能与硫酸反应,又能与氢氧化钠反应 | |
| D. | 既不能与硫酸反应,又不能与氢氧化钠反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 电解水和氢气燃烧的基本反应类型相同 | |
| B. | 矿泉水是由氢元素和氧元素组成的氧化物 | |
| C. | 净化水的常用方法有吸附、沉淀、过滤和蒸馏 | |
| D. | 在硬水里用肥皂洗衣服会出现泡沫多浮渣多的现象 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 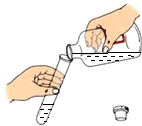 向试管中倾倒液体 | B. | 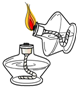 点燃酒精灯 | ||
| C. | 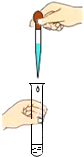 向试管中滴加液体 向试管中滴加液体 | D. | 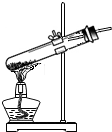 加热固体物质 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 请你帮助小强完成右图所示木炭在氧气中燃烧的实验,根据实验事实回答小强提出的问题:
请你帮助小强完成右图所示木炭在氧气中燃烧的实验,根据实验事实回答小强提出的问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
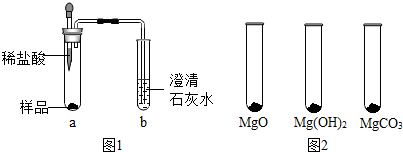
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/ml | 10.4 | 7.2 | 5.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com