
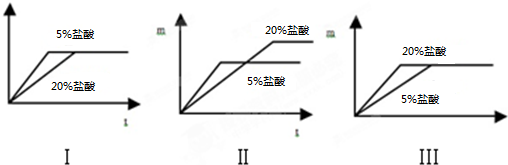
分析 (1)依据题干中关于盐酸浓度越大,反应速率越快的原理对金属与酸反应时的图象进行分析即可;
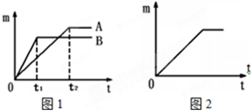
(2)可从反应速率和氢气生成量两的方面来判断,镁、锌的反应速率要比铁快,由关系式计算可知m克铁生成m/28克氢气,m克锌可生成m/32克氢气,m克镁可生成m/12克氢气,镁反应最快生成氢气最多;锌反应比铁快生成氢气最少;铁反反应最慢生成氢气量居中.
(3)根据接触面积越大反应的速率越大分析.
解答 解:(1)由于盐酸浓度越大,反应速率越快,所以放入到20%的盐酸中时铝片与盐酸反应的速度要比放入到5%的盐酸中铝片反应速度快,所以反应完全的时间要短,但氢气量没有变化.故选:Ⅲ.
(2)镁、锌的反应速率要比铁快,并且由化学方程式Fe+2HCl═FeCl2+H2↑、Zn+2HCl═ZnCl2+H2↑、Mg+2HCl═MgCl2+H2↑可知m克铁生成m/28克氢气,m克锌可生成m/32克氢气,m克镁可生成m/12克氢气.图中B线反应快生成氢气少,可知对应的金属为锌,A线反应速率比锌慢可知为铁.则曲线A对应的金属与稀盐酸反应后生成的盐的名称是氯化亚铁;故答案为:氯化亚铁;锌;
(3)由于接触面积越大反应的速率越大,锌粉和锌片分别放入溶质质量分数相同的足量稀盐酸中,锌粉与稀盐酸反应的速率比锌片与稀盐酸反应的速率小,所以反应完全的时间要长,但氢气量没有变化.图象为: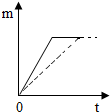 .
.
点评 此题是一道实验探究题,主要是考查了金属与酸的反应,只要掌握了金属与酸的反应规律以及控制变量法进行实验,便能顺利解题.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
| A. | OH-和Fe3+ | B. | H+和OH- | C. | Fe3+和K+ | D. | H+和Fe3+ |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
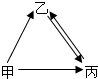 如图中甲、乙、丙均为初中化学常见的物质,已知它们均含有地壳中含量最多的元素,它们之间有如图所示的转化关系,丙是单质;甲、乙通常为液体,请按要求填写下列空白:
如图中甲、乙、丙均为初中化学常见的物质,已知它们均含有地壳中含量最多的元素,它们之间有如图所示的转化关系,丙是单质;甲、乙通常为液体,请按要求填写下列空白:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 输电线 | B. | 坚韧的防弹衣 | C. | 保温隔热材料 | D. | 发光二极管 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com