
 CO+H2;该反应是一种单质和一种化合物反应生成一种单质和一种化合物,属于置换反应.
CO+H2;该反应是一种单质和一种化合物反应生成一种单质和一种化合物,属于置换反应. CO+H2;置换反应.
CO+H2;置换反应.

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 物质 | 开始沉淀 | 沉淀完全 |
| 氢氧化铜 | 4.7 | 6.7 |
| 氢氧化铁 | 1.5 | 4.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 (2004?厦门)下面是在鼓浪屿淑庄花园前新设的一组垃圾箱及说明:
(2004?厦门)下面是在鼓浪屿淑庄花园前新设的一组垃圾箱及说明:| 厦门市生活垃圾分类种类 | ||
| 可回收 垃圾 |
不可回收垃圾 | 有害 垃圾 |
| 1.纸类 2.玻璃 3.金属 4.塑料 5.橡胶 6.纺织品 |
1.厨房垃圾 2.灰土 3.杂草 4.枯枝 5.花卉 |
1.日光灯管 2.电池 3.喷雾罐 4.指甲油瓶 5.药品药瓶 6.涂改液瓶 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 有一种矿石称为“孔雀石”,它有孔雀羽毛般绿色斑纹,它的主要成分是碱式碳酸铜[Cu2(OH)2CO3].因碱式碳酸铜中含有铜元素,某兴趣小组同学对如何从孔雀石中提炼金属铜产生了浓厚兴趣,为此采集了适量的孔雀石样品,在老师的指导下进行了下列探究活动.
有一种矿石称为“孔雀石”,它有孔雀羽毛般绿色斑纹,它的主要成分是碱式碳酸铜[Cu2(OH)2CO3].因碱式碳酸铜中含有铜元素,某兴趣小组同学对如何从孔雀石中提炼金属铜产生了浓厚兴趣,为此采集了适量的孔雀石样品,在老师的指导下进行了下列探究活动.| 步骤和方法 | 现象 | 分析 |
| 取7.2g红色固体,置于烧杯中,向其中加入足量的稀硫酸,充分搅拌,静置. | 若无变化现象. | 证明红色固体是 Cu Cu . |
| 若 溶液变蓝色 溶液变蓝色 . |
证明红色固体肯定含有 Cu2O Cu2O . | |
| 取上述反应后的溶液过滤,洗涤、干燥和称量,得固体质量为6.8g. | ╱ | 确认红色固体是 Cu和Cu2O的混合物 Cu和Cu2O的混合物 . |
查看答案和解析>>
科目:初中化学 来源: 题型:

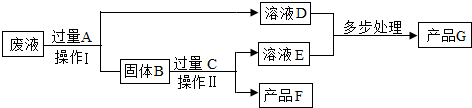
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com