
【题目】侯氏制碱法生产的碳酸钠中常含有少量的氯化钠。某学习小组对其组成展开探究。取碳酸钠和氯化钠的混合物样品24g,加入100g水使其完全溶解,再加入96g过量的氯化钙溶液,反应过程中生成沉淀的质量与氯化钙溶液的质量关系如图所示:
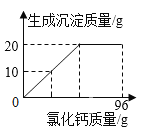
(1)完全反应时,得到的沉淀质量是_____g。
(2)计算样品中Na2CO3的质量分数_____。(写出计算过程,结果保留一位小数)。
(3)通过已知数据,可以求出的量有_____(写字母)。
A 反应后溶液的总质量
B 参加反应的氯化钙质量
C 氯化钙溶液中溶质的质量分数
D 恰好完全反应时,溶液中氯化钠的溶质质量分数
(4)取混合物样品24g,加入足量的稀盐酸,将生成的二氧化碳通入盛有8g炽热碳粉的密闭容器中充分反应,在下图中画出二氧化碳的质量与容器中固体质量变化的关系图_____。
【答案】20 88.3% AB 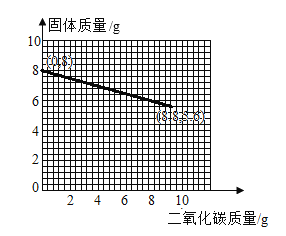
【解析】
(1)根据图可知生成的沉淀的质量为20g;
(2)解:设碳酸钠的质量为x,生成的氯化钠的质量为y,参加反应的氯化钙的质量为z。
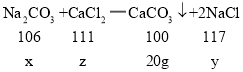
![]()
解得: x=21.2g y=23.4g z=22.2g
样品中 Na2CO3 的质量分数为:![]() ×100%≈88.3%
×100%≈88.3%
(3)A、反应后溶液的总质量24g+100g+96g-20g=200g,符合题意;
B、参加反应的氯化钙质量为22.2g,符合题意;
C、只知道反应的氯化钙的质量,而氯化钙溶液的质量是过量的,所以氯化钙溶液中溶质的质量分数没法求算,不符合题意;
D、只能求算恰好完全反应时氯化钠的质量为23.4g+24g-21.2g=26.2g,而恰好完全反应时,溶液的质量无法求算,所以溶液中氯化钠的溶质质量分数无法求算,不符合题意。故选AB。
(4)取混合物样品24g,含有碳酸钠的质量为21.2g,设生成的二氧化碳的质量为a,
根据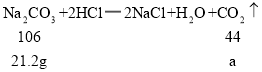
![]()
解得:a=8.8g,
设二氧化碳完全反应消耗的碳的质量为b,
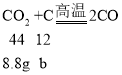
解得b=2.4g, 则剩余的碳的质量为8g-2.4g=5.6g。
所以图像的起点为(0,8),终点为(8.8,5.6),故二氧化碳的质量与容器中固体质量变化的关系图如图所示。



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
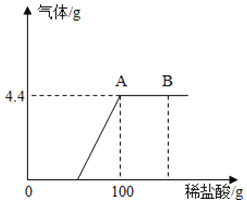
【题目】某化学小组在实验室里发现一小袋包装破损的氢氧化钠固体,想通过实验和计算确定样品中Na2CO3的质量分数.经称量,发现这包变质的氢氧化钠样品质量为18.6g,将它溶于水,加入一定质量分数的稀盐酸直至过量.测出加入稀盐酸的质量与产生气体的质量如图(假设产生的气体全部逸出).
试计算:
(1)样品中碳酸钠的质量分数(结果精确至0.1%).______
(2)加入的稀盐酸的质量分数.______
(3)B点时,烧杯内溶液中的溶质是_____(写出化学式).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NaOH在工业上具有广泛的应用,某研究性学习小组通过以下实验探究NaOH的性质。
实验一 向两块固体表面滴加稀盐酸 | 实验二 振荡2个塑料瓶 |
|
|
(1)实验一中滴加盐酸后产生的气泡的化学式为_______________。
(2)实验二中振荡2个塑料瓶,观察到塑料瓶变瘪的程度为A>B, A瓶出现沉淀,B瓶中先有白色沉淀,继续振荡后沉淀消失。
①请说出一-种鉴别NaOH固体和Ca(OH)2固体的物理方法:__________________。
②B瓶中产生沉淀的化学方程式为_________________。
(3)在20°C时,研究小组对A瓶中产生沉淀的原因及成分做了如下探究:
[提出问题]两只塑料瓶中发生了哪些反应,得到了哪些物质?
[查阅资料]①20°C时,有关物质的溶解度如下表所示:
物质 | NaOH | Ca(OH)2 | Na2CO3 | NaHCO3 | CaCO3 | Ca(HCO3)2 |
溶解度/g | 109 | 0.18 | 21.5 | 9.6 |
| 16.6 |
②CO2可以与Na2CO3溶液发生反应: ![]() 。
。
③NaHCO3固体在120°C开始分解: ![]() 。Na2CO3 加热不分解。
。Na2CO3 加热不分解。
④常温下,饱和Na2CO3溶液pH为12.3, 饱和NaHCO3溶液pH为8.1。
根据以上资料和实验现象推断:B瓶最终所得澄清溶液中所含溶质为____________。
[提出猜想]对A瓶中沉淀成分有以下四种猜想:猜想Ⅰ : NaOH和Na2CO3;
猜想Ⅱ: Na2CO3; 猜想Ⅲ: Na2CO3 和NaHCO3; 猜想Ⅳ: NaHCO3。
小组同学经过讨论分析后,认为“猜想I”不成立,其理由是___________________。
[实验探究]将A瓶固体过滤后,用冰水洗涤,在烘箱中烘干。烘箱温度应控制为_______________。
小组甲:取2g固体溶于98gH2O配成溶液,用pH试纸测得其pH约为11。则_______________(填“猜想Ⅱ”、“猜想Ⅲ”、“猜想Ⅳ”)不成立。.
小组乙:取干燥固体在硬质大试管中加热,并将导管通入装有澄清石灰水的烧杯中。加热过程中,一直未见烧杯中有沉淀产生;将试管中固体冷却后称量, 其质量__________(填“变大”“变小”或“不变”)。
[实验结论]____________(填“猜想Ⅱ”、“猜想Ⅲ”、“猜想Ⅳ”)是正确的。
[反思评价]若不进行实验操作,仅通过比较塑料瓶中气体和溶液中溶质质量的相对关系,也可推断出A瓶中所得产物种类,还需要查阅或测量的数据是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有两瓶无色溶液,可能是盐酸或者是氢氧化钠,化学实验小组同学想对这两瓶试剂进行鉴别(查阅资料,铝既可以和盐酸反应,也可以和氢氧化钠溶液反应,铝和氢氧化钠溶液反应生成偏铝酸钠( NaAlO2)和氢气)。
(1)甲组同学做了如下的实验
实验步骤 | 实验现象 | 实验结论 |
取一支试管,加入5ml无色液体,并加入紫色的石蕊试剂 | 溶液变________色 | 无色溶液是_______ |
取一支试管,加入5ml无色液体,并加入紫色的石蕊试剂 | 溶液变________色 | 无色溶液是NaOH |
(2)乙组同学用的是铝来进行的实验。取一支试管加人5毫升的无色液体,发现有气泡生成。然后同学们就说这是盐酸。此反应的化学方程式为:________________________。
(3)丙组的同学认为此方法有错,你认为乙组同学错的理由是_______________,化学方程式为______________。
(4)丁组同学在做铝与盐酸反应的实验时收集到了氢气0.2克,需要铝粉_______________克?消耗了50克的盐酸溶液,此溶液的溶质的质量分数是____________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具。元素周期表能够反映元素原子结构的许多信息,原子结构与元素的性质和物质的组成有关。请根据元素周期表中钙元素的“身份证”(见下图),填写以下各图中横线上的空白。
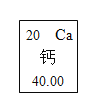
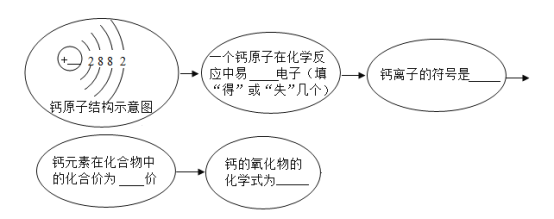
(1)_____(2)_____(3)_____(4)_____(5)_____ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示,下列说法正确的是

A. t1℃时,甲、乙的溶液中所含溶质质量相等
B. t2℃时,将50g甲加入5Og水中,可得到100g溶液
C. 甲中含有少量乙时,可用降温结晶法提纯甲
D. t1℃时分别将甲、乙的饱和溶液升温至t2℃时,所得溶液的溶质质量分数甲>乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生物体中含有多种氨基酸.下列有关甘氨酸的叙述正确的是( )
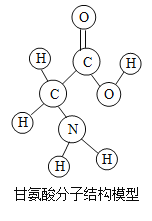
A.甘氨酸是有机高分子化合物
B.一个甘氨酸分子中含有10个原子
C.甘氨酸是由碳、氢、氧、氮四种原子构成的
D.甘氨酸中碳原子与氢原子的个数比为24:5
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了解甲酸的分解产物,实验小组进行了以下探究:
[查阅资料]①甲酸(HCOOH)的熔点为8.6℃,能分解生成两种物质;
②氧化铁为红棕色粉末,铁粉为黑色。
[提出猜想]实验小组对甲酸的分解产物提出了猜想:
猜想1.H2和CO2:猜想2.CO和H2O。
[设计实验]20℃时,甲酸的状态为_____:从图(一)装置中选择合适的装置_____(填序号)对甲酸进行加热。为了加快分解速率,实验小组加入了催化剂,反应后将分解产物通入图(二)装置进行实验。
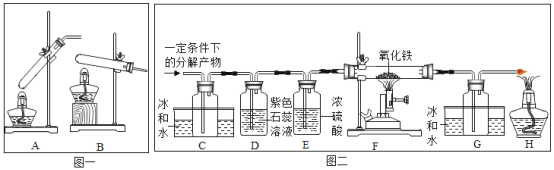
[实验预测]若猜想1成立,则D中的实验现象应为_____。
[进行实验]实验中观察到C处瓶内出现的现象为_____,F处玻璃管中出现红棕色粉末变成黑色且G处瓶内无明显现象,则甲酸分解的化学方程式为_____。
[交流拓展]资料表明,不同条件下,甲酸的分解产物不同,猜想1和猜想2均能成立。据此小新对甲酸的分解产物又提出新猜想:猜想3.H2O和CO2;猜想4.CO和H2。经讨论认为无须进行实验就能确定猜想3和猜想4都错误,理由是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
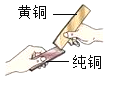
【题目】合金是重要的金属材料.
(1)下列物品所使用的主要材料属于合金的是_____;
A青花瓷瓶 B橡胶充气艇 C不锈钢锅
(2)生铁是常见的合金,生铁属于_____(填“纯净物”或:混合物)
(3)黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片行留下明显的划痕,说明_____.
(4)黄铜渣中主要含Zn、ZnO、Cu、CuO,其余为杂质,处理黄铜渣可得到硫酸锌,其主要流程如下(杂质不溶于水、不参加反应);

下列说法正确的是_____;
A Ⅰ、Ⅱ中的操作均包括过滤
B 溶液A一定为无色
C 溶液A的质量小于溶液B.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com