
【题目】某集气瓶里盛有氮气和氧气的混合气体(体积比为4:1),采用燃烧法要除去氧气而得到较纯净的氮气,选用的试剂最好是( )
A.铝箔 B.红磷 C.木炭 D.硫黄
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。某兴趣小组同学对其进行探究。
一、过氧化钙的性质研究
(1)取少量过氧化钙放入试管中,加足量水,产生无色气泡,将带火星的木条伸进试
管中,观察到带火星的木条 ,说明过氧化钙与水反应有氧气生成。
(2)分别取实验(1)静置后的上层清液少量于两支试管中,向其中一支试管中滴入酚酞试液,发现溶液变成红色,说明溶液呈 性;向另一支试管中通入二氧化碳,溶液变浑浊,说明过氧化钙与水反应还有氢氧化钙生成。
结论:过氧化钙和水反应生成氢氧化钙和氧气。
二、过氧化钙的制备研究
实验室用钙盐制备CaO2,其主要实验装置(图1)和流程(图2)如下:
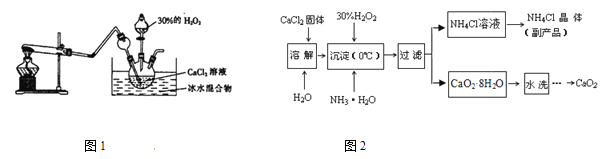
(3)图1试管中的物质是NH4Cl和Ca(OH)2,加热时发生反应生成CaCl2、NH3 和H2O,
反应的化学方程式为 。
(4)“沉淀”时发生的反应为:CaCl2+H2O2+2NH3·H2O+6H2O=CaO2·8H2O↓+2NH4Cl,需
要控制温度在0℃左右,采用的操作是将反应容器放置在 中,反应温度不能过高
的原因是:①防止氨水挥发;② 。
(5)“过滤”所得的副产品NH4Cl可做化肥中的 肥。检验“水洗”已经洗净的方
法是:取最后一次洗涤液少量于试管中, 。
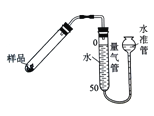
(6)加热分解法是测定CaO2产品纯度的常用方法之一(2CaO2 ![]() 2CaO+O2↑)。
2CaO+O2↑)。
右图是实验室测定产品中CaO2纯度的装置。实验步骤:检查装置的气密性→装填药品0.30g→调节量气管和水准管两边水位相平→加热至不再有气体放出→冷却至室温,调节量气管和水准管两边水位相平→读数→再重复2次,取平均值,计算。(已知:该温度和压强下的O2密度为1.43g/L)
根据下表数据,计算CaO2产品纯度(请写出计算过程)。
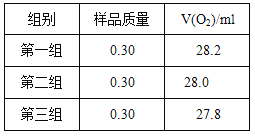
若样品质量用wg表示,反应前称量药品和小试管总质量为mg,反应后在空气中冷却,称量药品和小试管总质量为ng,则CaO2纯度![]() ,此方案测定结果偏小的原因可能是 。
,此方案测定结果偏小的原因可能是 。
[
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一密闭容器中加入甲、乙、丙、丁四种物质,在下定条件下发生化学反应,测得反应前及t1、t2时各物质质量如右图所示。下列说法中不正确的是( )

A.该反应为化合反应
B.丙可能为该反应的催化剂
C.该反应中,乙、丁的质量变化之比为7:5
D.该反应中,甲、乙的质量变化之比为1:4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的速率影响效果,某研究小组进行了如下探究:

【定性研究】
(1)如图甲,可通过观察_________________来定性比较两者的速率影响效果。
【定量研究】
(2)如图乙,实验前检查该装置气密性的方法是__________________________。要定量比较两者的速率影响效果,可测量生成等体积气体所需的_______________。
【深入研究】
(3)在FeCl3溶液中,究竟是哪种粒子影响过氧化氢的分解速率?
猜想1:水分子(H2O)影响过氧化氢的分解速率;
猜想2:___________影响过氧化氢的分解速率;
猜想3:___________影响过氧化氢的分解速率;……
请设计实验,验证猜想
实验操作 | 实验现象 | 实验结论 |
分别取同温度同体积同浓度的H2O2溶液于2支试管中,再分别加入等质量的FeCl3和NaCl。观察现象。 | 加入FeCl3的试管中产生的气体快,加入NaCl的试管中产生的气体慢。 | 证明是Fe3+影响过氧化氢的分解速率 |
(4)【反思与讨论】上述实验确实可以证明Fe3+可以改变过氧化氢的分解速率,但不能证明FeCl3是过氧化氢分解的催化剂。若要证明FeCl3是过氧化氢分解的催化剂,还需要通过实验证明FeCl3在反应前后 ___________________ 。
请写出FeCl3催化H2O2分解的化学方程式___________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如表是部分物质的溶解性表(室温),利用表中提供的信息回答下列问题:

(1)酸、碱、盐之间发生的复分解反应,其实质是它们的溶液中离子之间相互结合生成沉淀或气体或水,否则反应就不能发生.则 BaCl2溶液和 NaNO3溶液混合后___(7)____(填“能”或“不能”)发生复分解反应.
(2)写出一个有 BaSO4生成的中和反应化学方程式____________(8)______________________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组利用硫酸厂的烧渣(主要成分为:铁的氧化物、少量FeS及SiO2),在实验室制备碱式硫酸铁[化学式为Fex(OH)y(SO4)z·nH2O],主要流程如下:
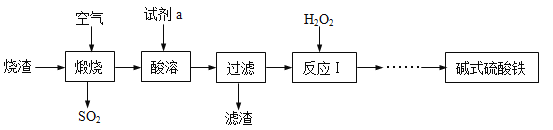
(1)焙烧时产生的二氧化硫可用石灰乳吸收,发生反应的化学方程式为 ,该步骤中用石灰乳而不用澄清石灰水的原因是 。
(2)酸溶时加入的试剂a是 (填化学式),酸溶时发生反应的属于 反应(填基本反应类型)。过滤后获得的滤渣的主要成分是 。
(3)反应l中加双氧水的目的是为了将溶液中的Fe2+氧化为 (填离子符号)。双氧水作为该反应氧化剂的优点是 。
(4)流程中获得碱式硫酸铁[化学式为Fex(OH)y(SO4)z·nH2O]前省略的操作是 ﹑冷却结晶﹑ 和低温烘干。
(5)为确定碱式硫酸铁的化学式,进行了如下实验:
①称取1.692 g碱式硫酸铁样品溶于足量的稀盐酸中并充分混合;
②向①所得的混合物中加入足量的BaCl2溶液,充分反应后,经过滤、洗涤、干燥、称重,得沉淀2.330 g。
③若向步骤②的滤液中加入过量的NaOH溶液,充分反应后,再将沉淀过滤、洗涤、灼烧、称重,得固体0.640g。则碱式硫酸铁[Fex(OH)y(SO4)z·nH2O]样品中的y∶z的值为
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊是初中几种常见的物质,它们分别由氢、碳、氧、氯、钠、锰中的1~3种元素组成。

(1)甲的固体是天然存在的最硬的物质,其化学式为 。
(2)乙是密度最小的气体,它在空气中燃烧的化学方程式为 。
(3)气体丙与氧气在点燃的条件下发生反应,其微观示意图如下图,请在方框中补全相应微粒的图示。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com